揭秘特辑三 | 外泌体分离技术调研报告,是否有你在用的方法?
2025-09-22 14:20点击次数:317
关键词:外泌体分离外泌体的分离与表征 特辑三
外泌体分离技术,从复杂到高效
在生物医学研究的前沿,外泌体正逐渐成为连接基础研究与临床应用的桥梁。这些微小的细胞外囊泡,携带着丰富的生物信息,不仅在细胞间通讯中扮演着重要角色,还在疾病诊断和治疗中展现出巨大潜力。然而,要将外泌体从实验室推向临床,分离与表征技术是必须攻克的关键环节。
今天,就让我们深入探讨有哪些外泌体的分离技术,以及这些技术如何为外泌体的研究和应用提供有力支持。

谈到外泌体分离纯化,是不是首先想到就是超速离心?
除了超速离心,还有哪些高效的分离方法?
这些分离方法各有什么优劣势?
适用于哪些应用场景?
其他人都是如何选择的?
带着这些问题
各位读者老爷,接着往下看
01
外泌体的分离方法有哪些?
在外泌体分离方法中,超速离心无疑是目前最广泛使用的技术。
然而,超速离心也存在一些局限性。例如,分离的外泌体可能非囊泡性大分子的污染,这对于后续的组学分析、RNA分析和功能性EV分析可能产生不利影响。
此外,超速离心还可能引起EVs的聚集,这不仅会影响流式细胞仪分析和单颗粒跟踪分析的结果,还可能影响EVs在体内的生物分布。
为了克服超速离心的局限性,可以从MISEV2023中寻找合适的分离方案。
从MISEV2023中寻找外泌体分离方法
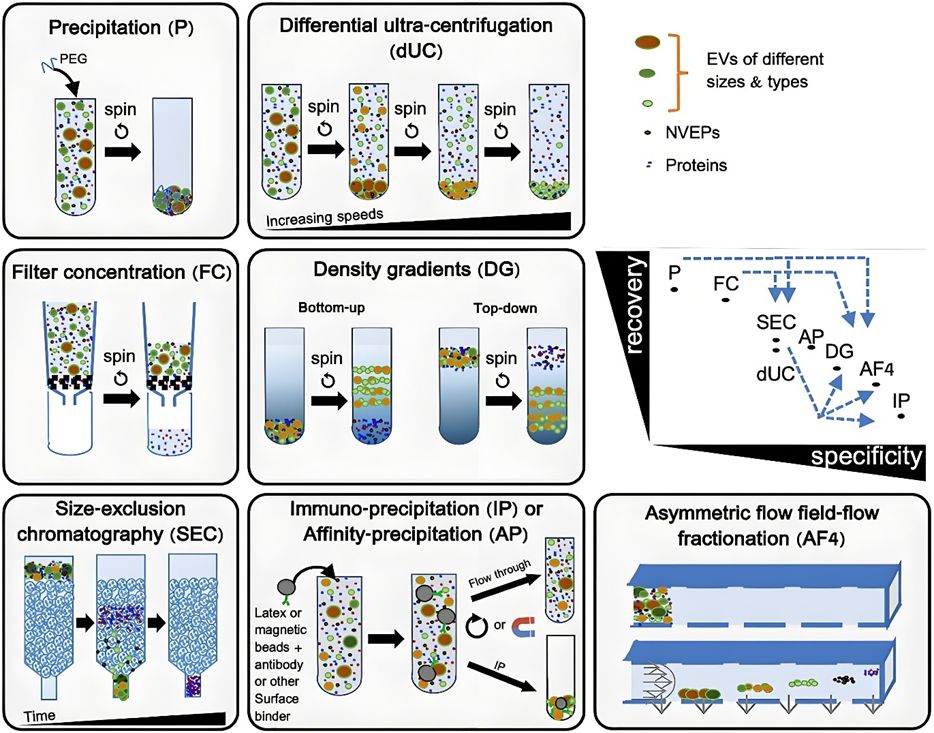
常见分离外泌体方法的工作原理。图中详细描述了在回收率和纯度二维图中各种分离方法所处的位置。
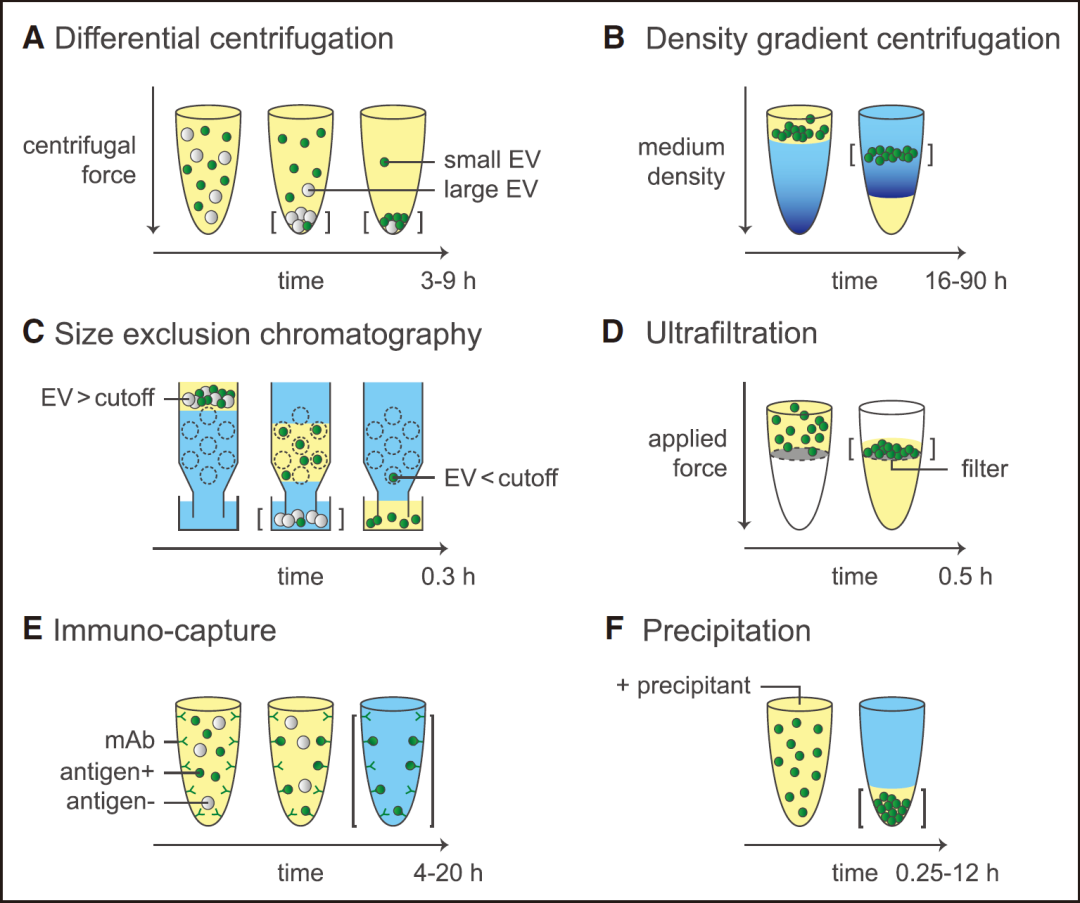
常见的外泌体分离方法原理与操作时间。直括号表示分离出的EVs;黄色表示可溶性成分;蓝色表示缓冲液。A,在差速离心中,分离是基于大小进行的,大EVs(灰色)比小EVs(绿色)更早地在管底沉淀,且所需的g力更低。可溶性成分不受离心的影响,但非EV颗粒(如脂蛋白和蛋白质聚集体)可能会与EVs共沉淀。B,在密度梯度离心中,分离是基于密度进行的,EVs会移动到它们的平衡密度处。非EV颗粒(如脂蛋白)可能因为密度相似或相互作用而与EVs共洗脱。相对梯度密度较高的可溶性成分会沉淀在管底。C,尺寸排阻色谱法使用多孔基质(虚线圆圈)按大小分离。小于尺寸截止值的可溶性成分和颗粒会暂时进入多孔基质,而大于尺寸截止值的EVs和颗粒则不会进入多孔基质。因此,大于尺寸截止值的EVs和颗粒会比小于尺寸截止值的可溶性成分和颗粒更早地洗脱出来。D,在超滤中,小于尺寸截止值的可溶性蛋白和颗粒会被推过滤膜,EVs则在滤膜上被收集。E,在免疫捕获实验中,EVs是基于它们的免疫表型被捕获的。使用针对目标(绿色)EVs表面暴露的抗原的单克隆抗体(mAb)来捕获EVs。F,在沉淀法中,加入沉淀剂会诱导EVs、非EV颗粒和可溶性蛋白聚集。这些聚集体会沉淀,沉淀可以通过离心来加速。
02
各分离方法的特点
传统分离技术之超速离心
超速离心是目前最常用的外泌体分离技术之一。
通过高速旋转产生的离心力,将外泌体从复杂的生物样本中分离出来。
这种方法能够获得较高纯度的外泌体,但操作复杂、耗时且产量有限。
超速离心通常需要多个步骤,包括差速离心和密度梯度离心。差速离心通过逐步增加离心速度,分离不同大小的颗粒,而密度梯度离心则利用外泌体的密度差异,进一步提高分离纯度。
尽管超速离心能够获得高质量的外泌体,但其低产量和高成本限制了其在大规模应用中的可行性。
传统分离技术之PEG沉淀法
沉淀法则通过添加聚合物或盐类,使外泌体从溶液中沉淀出来。这种方法操作简单、成本低,但纯度较低,且容易受到杂质的干扰。为了提高纯度,通常在沉淀后进行进一步的纯化步骤,如超速离心或SEC。
新型分离技术之超滤
为了克服超速离心的局限性,研究人员开发了多种新型分离技术。
超滤技术利用微孔膜的筛选作用,通过施加压力将外泌体从样本中分离出来。
这种方法操作简单、产量高,但纯度较低,且容易受到膜污染和堵塞的影响。
为了提高纯度,通常在超滤后结合其他技术,如尺寸排阻色谱(SEC)或免疫亲和捕获等。
新型分离技术之亲和捕获
亲和捕获技术在外泌体分离中的应用也值得关注。
亲和捕获是利用与外泌体表面物质特异性结合的配基实现外泌体捕获和分离的技术。该方法简单,快速,通常不需要与其他方法联用即可得到高纯度外泌体。
主要的缺陷是处理样本体积太小,价格太贵。
新型分离技术之微流控
近年来,基于微流控技术的外泌体分离方法逐渐兴起。微流控技术通过精确控制流体流动,实现外泌体的快速分离和富集。
这种方法不仅提高了分离效率,还减少了样品处理过程中的损失和污染。例如,一些微流控芯片能够在几分钟内完成外泌体的分离,且纯度和产量都达到了较高水平。
03
分离方法多维度对比分析
综合分析
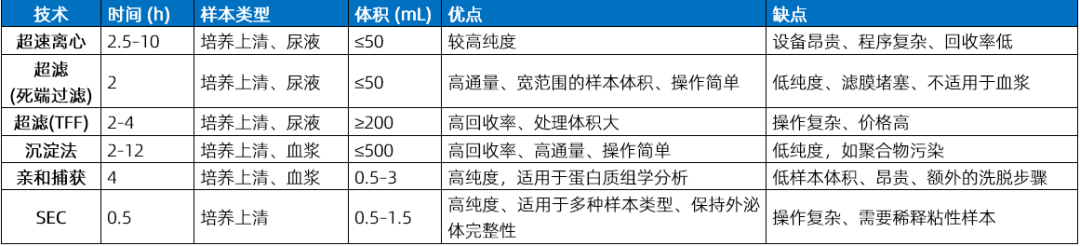
常见的外泌体分离技术的参数和优缺点。每种技术都有其独特的应用场景和适用范围。例如,超速离心适用于需要高纯度外泌体的研究,但操作复杂且耗时;而沉淀法则适用于大规模样本处理,但纯度较低。通过这种详细的比较,研究人员可以根据自己的研究需求选择最合适的分离方法。
相对产量、纯度和通量对比分析
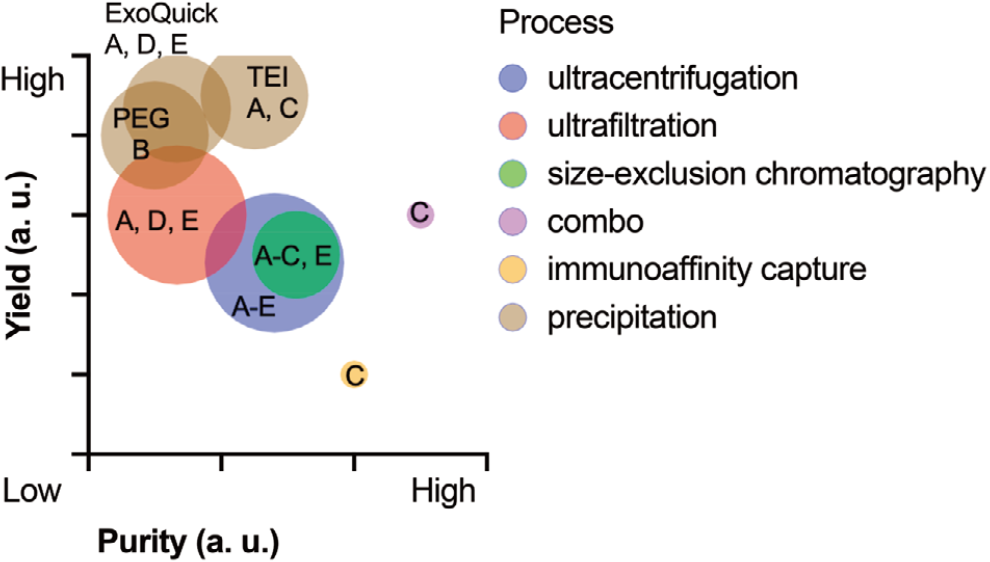
不同外泌体分离技术的相对产量、纯度和通量。定性数据来自比较研究,气泡大小表示每种方法相对于超速离心法的通量,超速离心法是外泌体分离的金标准。分析的沉淀法包括聚乙二醇(PEG)、Exoquick-TC和总外泌体分离。
每种技术都有其独特的优势和局限性,适用于不同的样本类型和研究目的。例如,超速离心虽然能够获得高纯度的外泌体,但操作复杂且耗时;而沉淀法则操作简单、产量高,但纯度较低。
通过这种比较,详细我们可以根据需求选择最合适的分离方法。
04
如何选择适合你的分离方法
超速离心无疑是目前最广泛使用的技术,占比高达81%,但是超速离心也有局限性,如非囊泡性大分子的污染、引起外泌体聚集等。为了克服超速离心的局限性,很多科学家也在开发新的分离方法或新工艺。
调查显示59%的外泌体研究者通常是多种分离方法组合使用。这些方法包括密度梯度离心(20%)、过滤(18%)和尺寸排阻色谱(SEC,15%)。这些技术的结合使用可以在一定程度上提高外泌体纯度和回收率。
此外,磁珠分离技术在外泌体分离中的应用也值得关注。虽然在条件培养基中使用磁珠分离的比例较低(3%),但在处理复杂生物材料时,这一比例上升到13%,并且在样本量小于1ml时,使用磁珠分离的比例进一步增加到28%。这表明磁珠分离技术在处理少量样本时具有一定的优势,尤其是在需要高纯度外泌体的实验中。
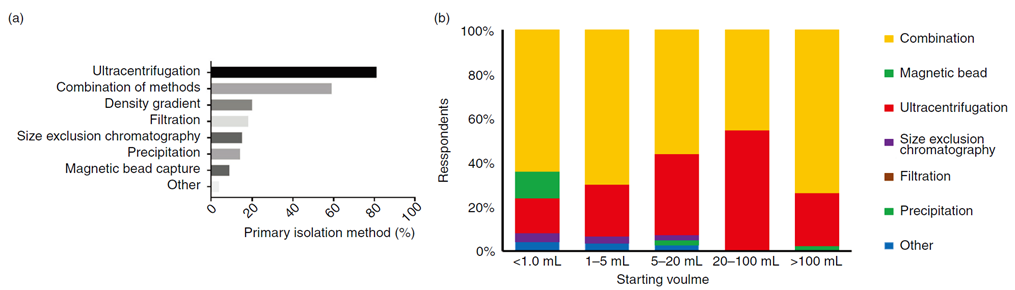
(a) 初次分离方法(受访者百分比)和 (b) 按起始材料体积划分的分离方法
分离技术的选择因素
样本的类型和体积对分离技术的选择有着显著的影响。
对于样本量较大的研究,如使用条件培养基的研究者,超速离心通常是特别好方法。
而对于样本量较小的研究,如处理复杂生物体液的研究者,磁珠分离和SEC等技术则更为常用。
此外,实验室的工作量也会影响分离技术的选择。
高通量实验室(每月处理50个或更多样本)更倾向于使用无血清培养基(72%)和血浆样本(76%),并且较少使用沉淀技术(4%),这可能是由于这些实验室需要快速、高效的分离方法来满足大量的样本处理需求。
分离材料的选择
条件培养基
调查结果显示,条件培养基是研究者最常使用的起始材料,占比高达83%。这表明大多数研究者倾向于从细胞培养上清中获取外泌体。
其中,29%的研究者同时使用含血清和无血清的培养条件,33%仅使用含血清培养基,而37%则完全采用无血清培养条件。
这一选择反映了研究者在实验设计时对于外泌体来源和特性的不同考量。
使用外泌体进行体内功能实验的研究者更倾向于选择无血清培养条件(64%),这可能是为了避免血清中的外泌体对实验结果产生干扰。
生物体液
除了条件培养基,生物体液也是外泌体分离的重要来源。其中,血浆(47%)、血清(22%)、尿液(14%)、脑脊液(8%)和乳汁(5%)是最常被分析的体液类型。
这些体液中的外泌体因其来源的复杂性,往往需要更精细的分离和纯化技术。值得注意的是,仅有4名研究者分析了非哺乳动物来源的外泌体(如细菌、线虫和寄生虫),这表明在这一领域的研究还相对较少,未来有较大的发展空间。
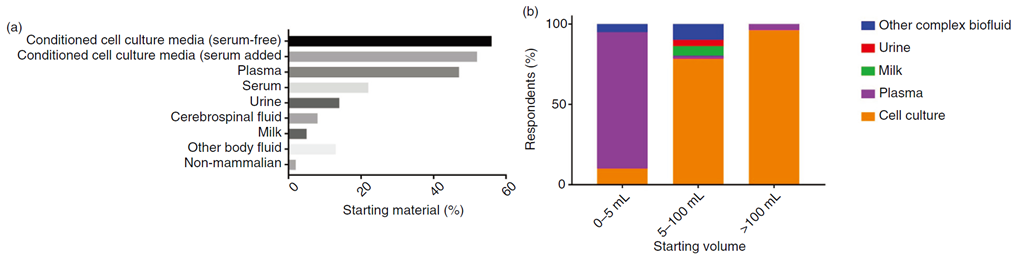
(a) 受访者使用的起始材料按百分比划分。 (b) 按样本类型划分的起始体积。只有表明单一类型样本的回应被纳入分析(0-5mL,n=22;5-100mL,n=51;>100mL,n=28)。
后面 将继续分享 外泌体分离和表征 特辑,保持关注哦
你做的是哪种样本类型,又用的是哪种高效的外泌体分离方法呢?
欢迎在评论区分享你的故事!

本周
本月
本年
LetPub发布最新SCI影响因子查询及期刊投稿分析系统
ELISpot试剂盒限时特惠!一口价低至500元,加赠免费读板服务
草甘膦(glyphosate)酶联免疫分析(ELISA)试剂盒使用说明书
应用gentleMACS™灌流技术从脂肪肝小鼠模型高效分离肝细胞与非实质细胞
单个细胞也能提取核酸?超全干货教你微量样本发高分(含完整电子版宝典资料))
链脲佐菌素 (Streptozotocin,STZ)-糖尿病动物模型造模
LetPub完整SCI影响因子、期刊分区查询系统
研究思路 | 多组学专题——如何进行转录组+蛋白组关联分析?
Elabscience® 从原料到标记,打造属于中国自己的流式抗体品牌
淋巴细胞百分比偏低原因解析
- 促销公告
- 更多 ›


