铁死亡重点整理:一篇就懂的笔记在这里

铁死亡由 Dixon 等人发表至今 10 年,相关研究快速进展,跟 arigo 一起速记铁死亡调控、研究趋势与疾病治疗潜力。

铁死亡:3 抗氧化路径
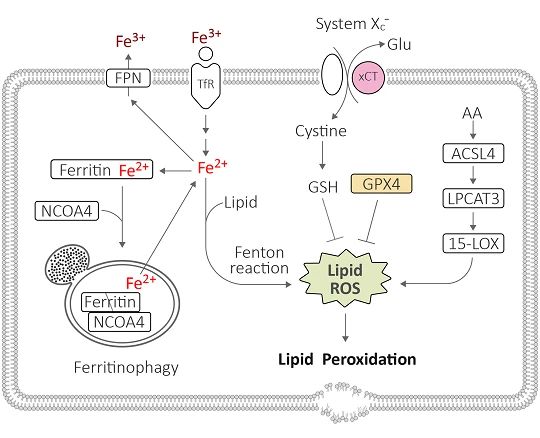
铁死亡 (Ferroptosis) 是新型细胞程序性死亡,由 “脂质过氧化” 诱发。细胞浆的脂肪酸与铁离子间的芬顿反应会产生脂质活性氧 (Lipid ROS),此时,xCT 会从胞外运输胱氨酸 (Cystine) 进胞内做为原料制造抗氧化剂谷胱甘肽 (GSH),随后 GPX4 通过消耗 GSH 来清除脂质活性氧,避免细胞受损。当 xCT、GPX4 蛋白水平损耗,脂质活性氧累积造成脂质过氧化,最终导致胞膜受损、细胞死亡,此为铁死亡核心 xCT/ GSH/ GPX4 路径。
简单说,铁死亡有 2 关键特征:
● 一定有 “脂质过氧化”
● xCT、GPX4 蛋白水平下降
这 2 大特征可用 arigo 铁死亡抗体组合包 (ARG30337) 轻松检测。

除了核心路径,另有 FSP1/DHODH/CoQ10、GCH1/BH4/DHFR 两路径分别以 CoQ10、BH4 作为抗氧化剂来避免脂质过氧化与铁死亡。
铁死亡调控
铁死亡的调控与成因高度相关,影响因子包含 GSH 代谢、铁离子、脂质。
GPX4、xCT
GPX4、xCT 是避免铁死亡最关键蛋白,其蛋白水平与活性直接影响铁死亡是否发生。GPX4 与 xCT 水平受到抗氧化反应关键转录因子 Nrf2 調控,当 Nrf2 被氧化应激活化会激活多条抗氧化通路,其中通过促进 GPX4 与 xCT 基因转录 可抑制铁死亡。因此铁死亡与 Nrf2 研究常同步进行。
arigo 的 Keap1-Nrf2-ARE 通路抗体组合包 (ARG30345) 方便研究 Nrf2 与铁死亡的调控。
GSH 代谢
GPX4 通过消耗 GSH 来避免铁死亡,若 GSH 量不足,一样会导致铁死亡。GSH 的原料是胱氨酸 (Cystine),由 xCT (胱氨酸/谷氨酸逆向转运蛋白) 从胞外转运而来,随后经蛋白酶作用生成 GSH。xCT 与 GSH 生成蛋白酶越多,越能避免铁死亡,而这些蛋白也是受 Nrf2 转录调控的。
胞浆铁离子含量
胞浆内的铁离子是导致脂质过氧化的关键因子,影响铁离子含量的蛋白参与铁死亡调控。当转铁蛋白受体 (TfR) 运输太多铁离子进胞浆、若铁蛋白 (Ferritin) 未能妥善储铁 (例如被铁自噬而无法储铁),导致铁离子过多诱发铁死亡。相反的,通过膜铁转运蛋白或外泌体将铁离子送出胞外,减少胞浆铁离子即可避免铁死亡。
胞浆脂质含量
除了芬顿反应,脂类代谢也会产生脂质活性氧、导致脂质过氧化,主要是 ACSL4/ LPCAT3/ 15-LOX 通路。另外 p53 也通过促进脂类代谢蛋白表达 (如12-LOX、SAT1) 调控铁死亡。
另外,胞浆脂质过多也是导致脂质过氧化的因子之一。当脂滴 (lipid droplets) 被自噬降解 (称为脂噬) 释放游离脂肪酸,促使脂质过氧化、导致铁死亡。
铁死亡疾病
铁死亡与许多疾病有关。许多癌细胞发现 xCT 过表达,而诱发铁死亡能促进癌细胞死亡,这一发现为抗癌药物研发带来新思路,特别是针对耐药性癌细胞诱导铁死亡,以清除癌细胞。另外在阿尔茨海默病 (AD) 与帕金森病 (PD) 的病理过程中也发现铁死亡特征:脂质过氧化和铁离子平衡故障,在动物模式针对 GSH-GPX4 通路靶向治疗可起到保护作用。这些发现让铁死亡在药物研发,不论是诱导癌细胞死亡或是减缓神经退行性疾病病程,均显示出巨大的潜力。




