一文详解 CGT 技术
2025-11-21 18:00点击次数:68
关键词:细胞与基因治疗(CGT)是通过直接修饰人类遗传物质或功能活细胞,从根本上修正致病缺陷的突破性技术。

图:细胞治疗过程(来源:沙利文)
与传统药物调控蛋白质功能的间接作用不同,CGT 从疾病源头切入,分为基因治疗和细胞治疗:
基因治疗通过递送外源基因或编辑工具(如 AAV 载体补充凝血因子治疗血友病/CRISPR 修复镰状细胞病突变基因);
细胞治疗则利用改造后的活细胞(如 CAR-T 靶向癌细胞/iPSC 分化为神经元)实现组织修复或精准杀伤。
其核心价值在于通过单次治疗达成终身治愈潜力,彻底改写疾病治疗逻辑。
一. 基因治疗:靶向遗传根源的双轨策略
1. 体内基因治疗
将携带治疗基因的载体直接递送至患者体内,通过替换或修正致病基因实现治疗。
主流技术:
病毒载体 ( AAV 等) 递送功能性基因: 长效表达治疗蛋白(如血友病凝血因子);
- 非病毒载体 ( LNP 等) 递送基因编辑工具 ( CRISPR ): 体内精准编辑致病基因(如转甲状腺素蛋白淀粉样变性)。
2. 体外基因治疗(基因修饰细胞疗法)
提取患者细胞,在体外进行基因改造(添加、修正、编辑),再将改造后的细胞回输给患者。
核心应用领域/产物:基因修饰的免疫细胞治疗(这是体外基因治疗最主要的产出)
CAR-T 细胞疗法: T 细胞装载嵌合抗原受体 (如靶向 CD19 ),治疗血液肿瘤 (特定适应症 CR 率>80%),实体瘤效果受限 (渗透不足)。
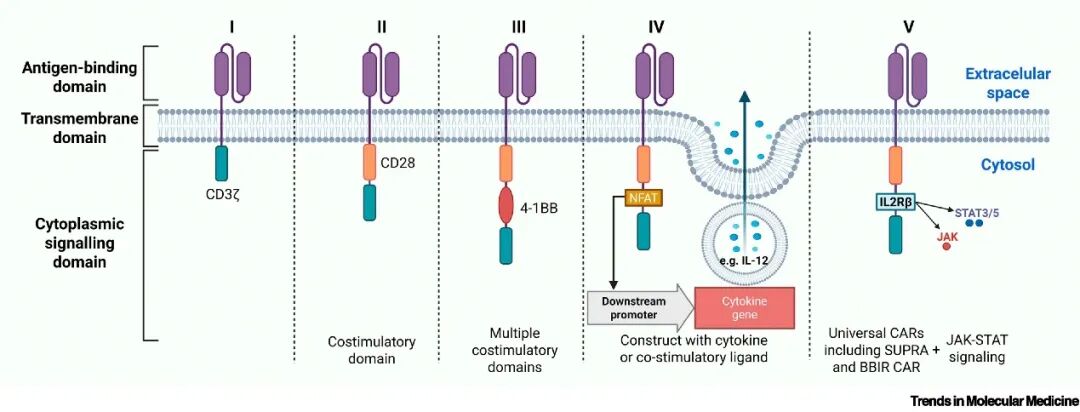
图:CAR技术的设计革新
(来源:Technologies for Chimeric Antigen Receptor Transgene Delivery 1)
TCR-T 细胞疗法:T 细胞装载优化/改造的 T 细胞受体 (如靶向 NY-ESO-1, MAGE-A4 ),增强识别胞内抗原能力,在实体瘤中取得进展;
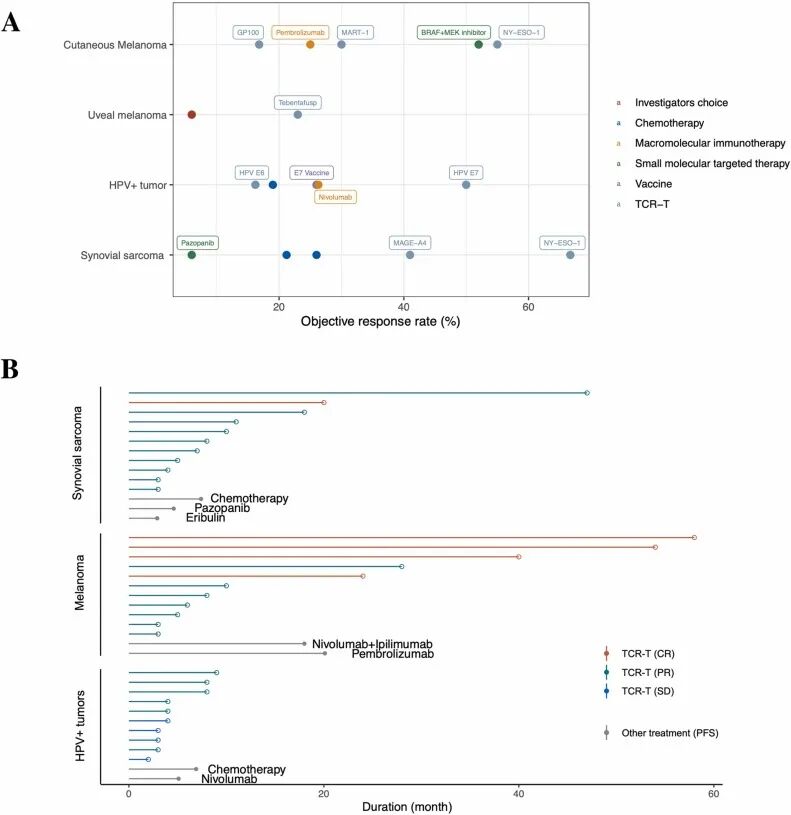
图:TCR-T 疗法在特定类型实体瘤中的显著疗效。与其他可用治疗方法相比。
(来源:Toward a comprehensive solution for treating solid tumors using T-cell receptor therapy: A review 2)
CAR-NK 细胞疗法:NK 细胞装载 CAR,具有「现货型」潜力 (通用型设计)。
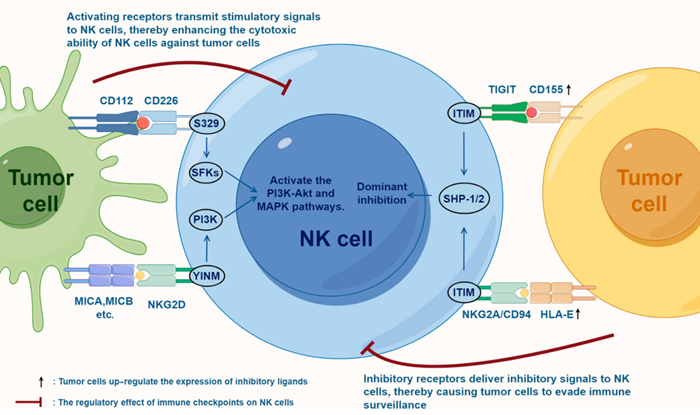
图:NK 细胞中激活受体与抑制受体之间的平衡
(来源:Natural Killer Cell Immune Checkpoints and Their Therapeutic Targeting in Cancer Treatment 3)
3、其他潜在应用:
如基因修饰造血干细胞治疗遗传病等
二. 细胞治疗:活细胞药物的双重使命
1. 基因修饰的细胞治疗
即由体外基因治疗技术产出的产品(主要就是上面提到的各种基因修饰免疫细胞疗法 CAR-T, TCR-T, CAR-NK 等)。这里可以强调这是体外基因治疗的主要应用产品。
2. 非基因修饰的细胞治疗:
肿瘤浸润淋巴细胞疗法:TIL 疗法 (分离、扩增肿瘤组织中的T细胞回输,通常不涉及基因改造),用于实体瘤治疗;
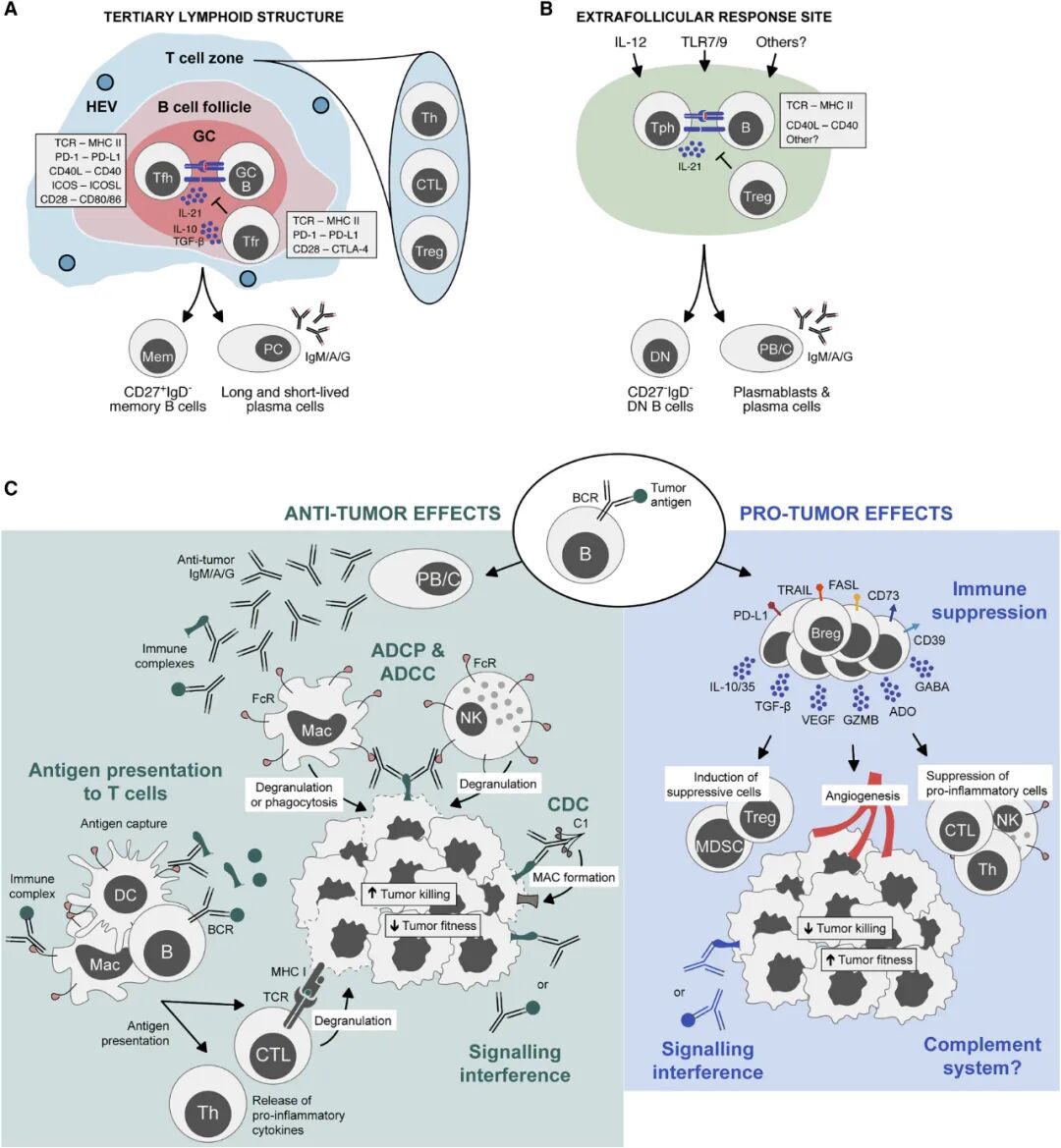
图:TIL 在抗肿瘤免疫中的肿瘤内位置和潜在作用
(来源:B cells in the tumor microenvironment: Multi-faceted organizers, regulators, and effectors of anti-tumor immunity 4)
干细胞移植:异体或自体造血干细胞移植 (HSCT),用于血液系统疾病、部分免疫疾病等;
间充质干细胞疗法:利用干细胞的免疫调节、组织修复功能治疗多种疾病 (炎症、退行性疾病等)。
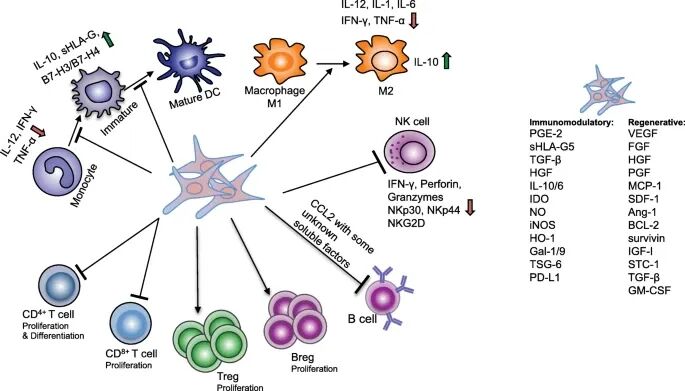
图:间充质干细胞介导免疫调节的机制
(来源:Mesenchymal stromal cell therapies: immunomodulatory properties and clinical progress 5)
3. 其他如调节性T细胞 (Treg) 疗法等。
三、载体:基因治疗的递送引擎
载体作为基因治疗的「精密装配线」,通过工程化改造实现治疗元件的高效递送,成为撬动 CGT 临床转化的核心基石。
1. 病毒载体是 CGT 技术落地的核心支撑。
腺相关病毒(AAV)作为体内基因治疗黄金载体,其衣壳工程可精准靶向组织(如 AAV9 突破血脑屏障),但载量(<4.7kb)与预存免疫限制应用,已推动多款药物上市,如 Zolgensma®;
图:不同 AAV 进化策略示意图
(来源:AAV vector development, back to the future 6)
慢病毒(LV)经四代安全迭代(删除非必需基因+四质粒系统),成为 CAR-T 等体外疗法的基因递送引擎,驱动白血病完全缓解率超 80%。腺病毒(AdV)通过三代改造降低免疫毒性,36kb 大容量载体适用于溶瘤疗法(如 Oncorine® 诱导肿瘤免疫原性死亡)。
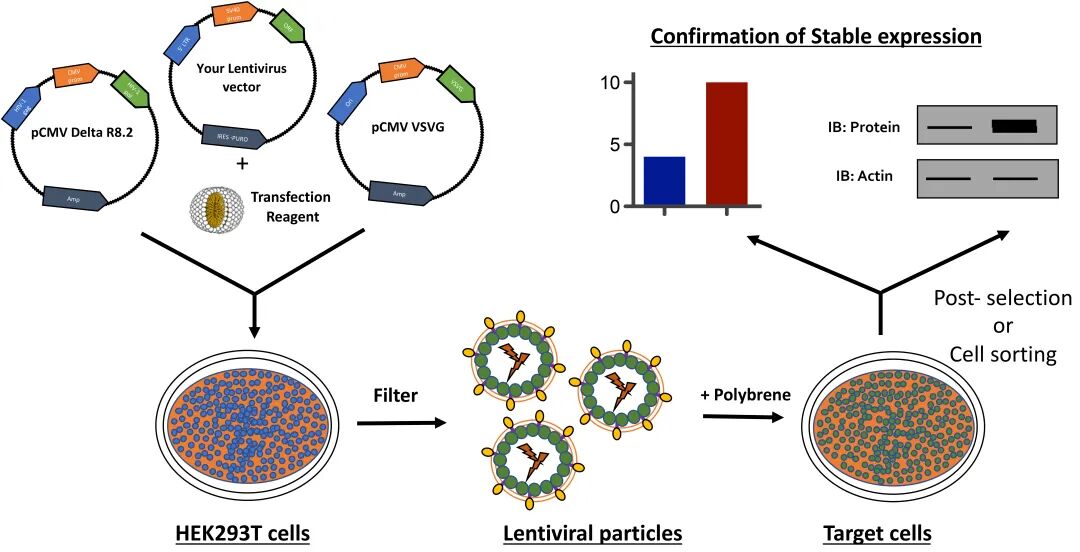
图:利用慢病毒产生稳定细胞系的示意图
(来源:Generation of Stable Expression Mammalian Cell Lines Using Lentivirus 7)
2. 载体工艺突破正加速产业化进程。
病毒载体的大规模生产仍面临提升产能和保障质量的双重挑战。为应对挑战,行业正积极开发多种先进工艺:
在腺相关病毒(AAV)方面,通过采用优化的悬浮培养技术结合高效生物反应器,显著提高了病毒产量;同时,运用先进的层析纯化技术有效降低了不完整病毒颗粒的比例;
对于慢病毒(LV),采用优化的培养基体系以减少生产过程中的杂质,并利用高效的浓缩技术实现高浓度病毒液的制备。
3. 非病毒载体递送平台的发展,提供了更具成本效益的替代方案。
作为非病毒递送平台的代表,质纳米颗粒(LNP)以「可编程靶向递送」与「模块化生产优势」,突破病毒载体局限。
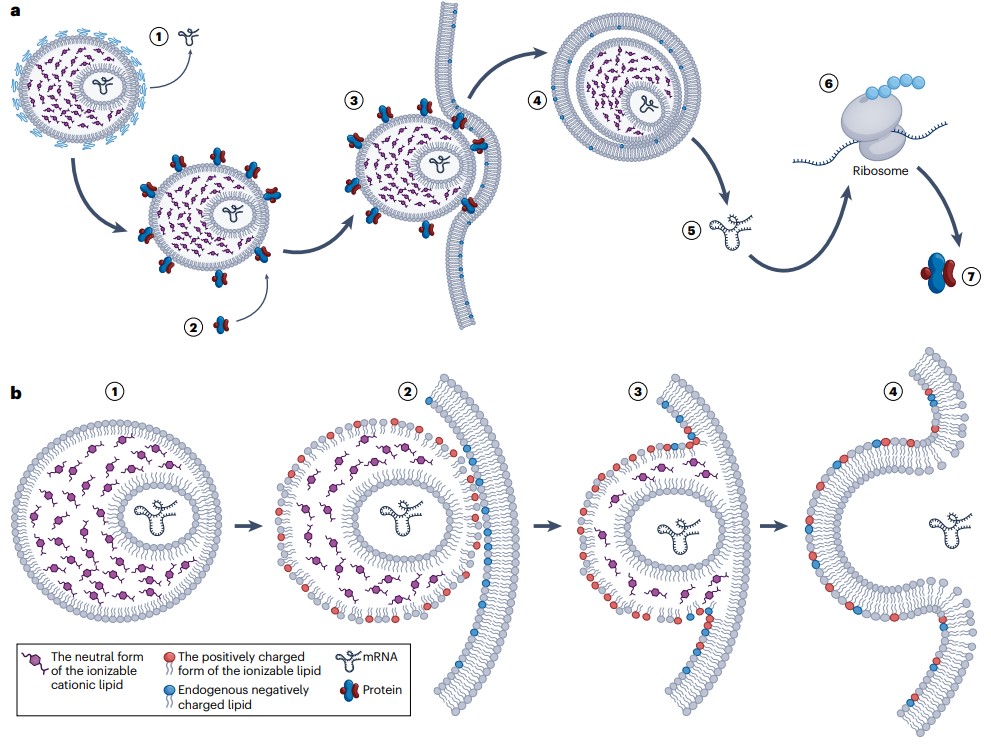
图:LNP mRNA递送系统的作用机制
(来源:The 60-year evolution of lipid nanoparticles for nucleic acid delivery 8)
结语:重塑疾病治疗的未来图景
CGT 技术正从概念走向临床,其核心突破在于将治疗维度从「控制症状」推进至「根治病因」。
病毒载体的持续革新(如靶向性 AAV 衣壳、高安全 LV 系统)与工艺优化(封闭式自动化产线)推动治疗成本下降;
细胞疗法在通用型设计、实体瘤突破等方向的进展不断拓展应用边界。
随着中国加速布局 GMP 产能与监管创新(如 NMPA 附条件审批通道),CGT 有望在未来十年实现对遗传病、癌症、退行性疾病的根本性征服,真正开启「一次治疗,终身治愈」的医学新纪元。




