Nature:西湖大学邹贻龙团队合作开发微米级蛋白质组学成像新技术
2025-11-13 18:00点击次数:81
关键词:2025 年 11 月 12 日,西湖大学邹贻龙团队及 Kiryl D. Piatkevich 团队在 Nature 发表题为「iPEX enables micrometre-resolution deep spatial proteomics via tissue expansion」的研究长文,成功开发了将基于水凝胶的蛋白质锚定、组织膨胀与基质辅助激光解吸/电离质谱成像(MALDI-MSI)深度融合的新技术 iPEX(in situ imaging Proteomics via Expansion)。

该技术突破了传统空间蛋白质组学在分辨率和检测灵敏度上的瓶颈,实现了在多种组织中以 1-5 微米有效像素尺寸、无偏、高通量地检测数百至逾千种蛋白质,为在单细胞及亚细胞水平解析蛋白质的空间分布和功能提供了强大工具。应用 iPEX 于阿尔茨海默病小鼠模型,研究者揭示了疾病早期发生的线粒体功能紊乱以及脂代谢关键酶 ACAA1 的下调如何驱动长链多不饱和脂肪酸生物合成障碍,为神经退行性疾病的早期分子事件提供了新颖见解。
一、空间蛋白质组学的「分辨率困境」
在生命科学的「后基因组时代」,蛋白质作为生命活动的主要执行者,其表达水平、修饰状态和空间定位共同决定了细胞的命运与功能。近年来,空间转录组学技术蓬勃发展,让我们能够以极高的分辨率窥见 RNA 在组织中的分布。然而,在蛋白质层面,实现同等分辨率的无偏分析却面临巨大挑战。
现有的空间蛋白质组学技术主要分为两类:
1、基于抗体的成像技术(如 CODEX、IMC):需要预先知道目标蛋白,并制备特异性抗体,无法发现新靶点,且通量受限于抗体数量。
2、基于质谱的技术:
激光捕获显微切割(LCM)结合液相色谱-串联质谱(LC-MS/MS):以 Deep Visual Proteomics 为代表,虽然能够实现无偏检测,但需要通过 LCM 分离目标区域,过程繁琐、通量低,且空间分辨率受限于切割精度(通常在 100 微米级别)。
基质辅助激光解吸/电离质谱成像(MALDI-MSI):无需标记,可直接在原位检测并绘制多种分子的空间分布图,具有高通量潜力。然而,受限于仪器激光光斑大小和电离效率,其空间分辨率通常难以低于 10 微米,且对于丰度较低的蛋白质,鉴定数目非常有限。
简而言之,「高分辨率」与「高覆盖度、无偏性」 在空间蛋白质组学领域似乎难以兼得。研究者们迫切需要一种能够打破现有物理与技术极限的新方法。
二、 iPEX 技术的诞生:当蛋白锚定与组织膨胀遇上质谱成像
受到组织透明化 (Tissue clearing) 与膨胀显微镜(Expansion Microscopy, ExM)的启发,西湖大学的研究团队开始思考:能否通过将组织中的蛋白质优先锚定到高分子网络上,来去除其他所有生物分子对质谱检测包括质谱成像检测的干扰,增加蛋白质的检测效率?同时,是否可以通过将蛋白锚定后的样本进行各向同性的物理膨胀,来突破质谱仪器检测的空间分辨率限制?
在技术设计中,膨胀显微镜的核心是通过将组织样本的特异性基团共价嵌入可膨胀的水凝胶中,使其在浸泡于水中时实现各向同性的物理放大,从而使得原本密集的生物结构被「拉开」,利用普通显微镜即可实现超分辨率成像。研究团队设想,如果组织被膨胀,那么原本低于质谱仪分辨率的细微结构将被放大,从而使得在膨胀后的组织上进行 MALDI-MSI 扫描时,其有效像素尺寸(Effective Pixel Size, EPS)得以等比例缩小。例如,以 30 微米的扫描像素尺寸(SPS)扫描一个线性膨胀了 6.2 倍的组织,其有效分辨率可达 4.8 微米。
然而,将这一设想变为现实面临多个环节的技术挑战:蛋白质如何在水凝胶中被有效锚定并实现各向均匀膨胀?膨胀过程会否导致蛋白质/肽段的丢失或扩散?经过膨胀和处理的样本是否仍能被有效酶解?释放的肽段能否与 MALDI 基质共结晶并有效电离?如何识别质谱成像获得的信号峰并匹配到多肽-蛋白质?
经过系统的优化,团队最终成功建立了完整的 iPEX 技术流程(图 1):
固定与锚定:组织切片后,使用 N-琥珀酰亚胺丙烯酸酯(NSA)将蛋白质共价锚定到水凝胶网络上。
凝胶化与均质化:进行单体聚合形成水凝胶,随后使用 SDS 等试剂进行组织均质化和蛋白质变性,使用 DTT-IAM 实现蛋白质还原、烷基化。
膨胀:在缓冲液中使水凝胶发生各向同性膨胀,线性膨胀因子(LEF)通常控制在 3-7 倍,最高可达 20 倍。
原位酶解与 MALDI 样品制备:将膨胀后的水凝胶转移到导电载玻片上,进行喷雾法蛋白酶(胰蛋白酶等)消化,将蛋白质原位酶切为肽段,最后沉积 MALDI 基质(CHCA)。
MALDI-MSI 数据采集与分析:在质谱仪上采集空间质谱数据,并通过自主研发的计算流程进行峰识别、去同位素、与邻近组织样本构建的 LC-MS/MS 谱图库进行比对,最终实现蛋白质的初步鉴定与空间定位。
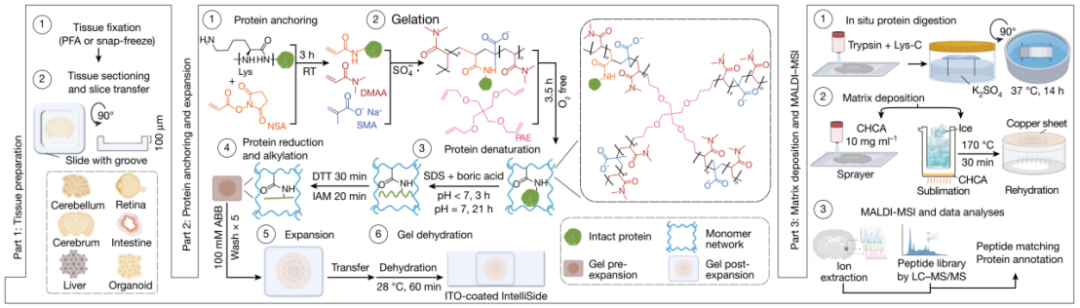
图 1
研究团队通过一系列严格对照的实验验证了 iPEX 的可行性。他们发现,标准肽段在膨胀后的水凝胶中依然可以被稳定检测且无明显的 m/z 偏移。在模型蛋白 BSA 和小鼠视网膜组织中,iPEX 展现出了远超传统 MALDI 的检测灵敏度:在 4.8 微米 EPS 下,iPEX 鉴定到 1862 个蛋白酶依赖性离子特征(推定为肽段),并注释出 334 个含有 ≥2 个独特肽段的高置信度蛋白质;而传统 MALDI 在 5 微米 SPS 下仅鉴定到 166 个离子和 20 个蛋白质。iPEX 在将空间分辨率提升了一个数量级的同时,将蛋白质的检测灵敏度提升了 1-2 个数量级。
三、 iPEX 的强大性能:从视网膜分层到全组织应用
为了全面展示 iPEX 的能力,研究团队在多种组织和模型系统中进行了测试。
1. 高分辨率解析小鼠视网膜精细结构
小鼠视网膜具有清晰的分层结构,是验证空间分辨率的理想模型(图 2)。iPEX 处理后的视网膜不仅完好地保留了其细胞构筑,还能清晰地分辨出光感受器层(PL)、外核层(ONL)、外丛状层(OPL)、内核层(INL)、内丛状层(IPL)和视网膜节细胞层(RGL)。通过无监督聚类分析,仅基于蛋白质表达谱,iPEX 就能自动将不同细胞层完美地区分开来。研究人员进一步鉴定出各层富集的标志性蛋白质,如光感受器层富集 S-抗原视觉抑制蛋白(SAG),ONL 和 INL(细胞核所在层)富集组蛋白 H1-4。这些结果均通过 MS/MS 碎片谱图和免疫荧光染色得到了验证。尤为值得一提的是,iPEX 甚至能够清晰地可视化 OPL 这一仅厚 15-25 微米的突触层中表达的蛋白质,如网格蛋白重链(CLTC),而传统 MALDI 几乎无法检测到该层的信号。
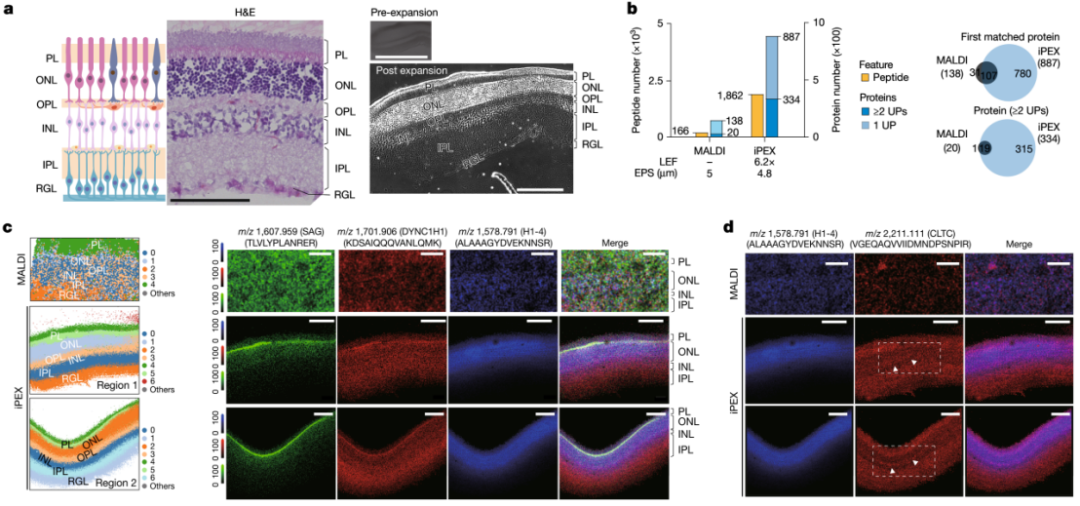
图 2
2. 广泛的组织适用性与高重复性
iPEX 的应用并不仅限于视网膜。研究团队在小脑、大脑、肠道、肝脏以及人胚胎干细胞来源的脑类器官中均取得了成功应用(图 3)。
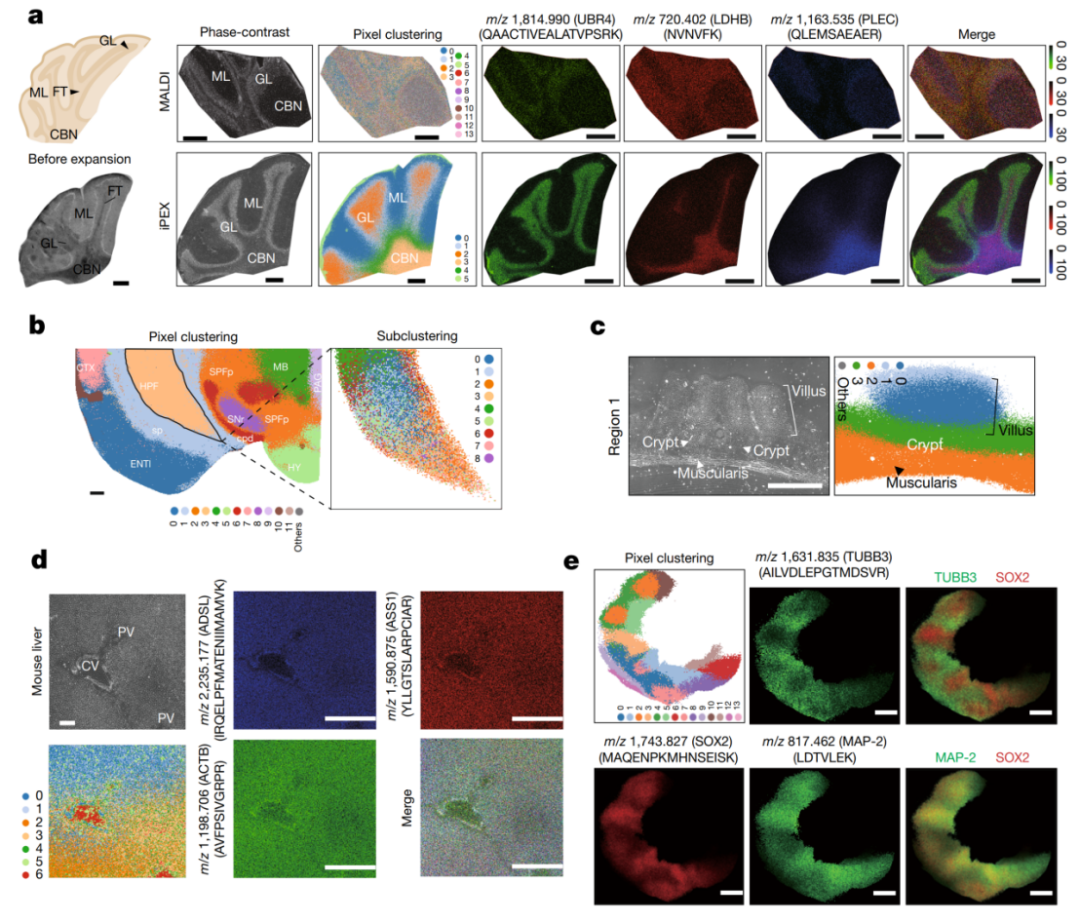
图 3
小脑:在 3.9 微米 EPS 下鉴定到 640 个高置信度蛋白质,像素聚类清晰区分出颗粒层、分子层和小脑核。
大脑:在 15.2 微米 EPS 下鉴定到 857 个蛋白质,聚类结果与 Allen 小鼠脑图谱的解剖结构高度吻合,并能对海马区进行亚结构解析。
肠道与肝脏:分别在 2.4 微米和 4.3 微米 EPS 下鉴定到超过 1000 个蛋白质,成功绘制出肠道隐窝-绒毛-肌肉层以及肝脏中央静脉-肝实质的蛋白质空间分布图。
脑类器官:在 10 微米 EPS 下鉴定到 1241 个蛋白质,揭示了类器官中神经前体细胞与分化神经元区域的空间异质性。
此外,通过荧光标记示踪和重复样本分析,研究证实 iPEX 流程中肽段的扩散极小(<2 微米),且技术重复性高,不同样本间肽段检测的一致性和强度相关性均非常出色。
四、 揭秘阿尔茨海默病空间蛋白质组景观
在证明了 iPEX 的技术实力后,研究者将其应用于 5xFAD 阿尔茨海默病模型小鼠,旨在揭示疾病发展过程中不同脑区的蛋白质组动态变化。
在 11 月龄的 5xFAD 小鼠脑中(图 4),iPEX 在 16.7 微米 EPS 下,在 WT 和 5xFAD 组分别鉴定到 971 和 968 个高置信度蛋白质。差异表达分析揭示了疾病相关的蛋白变化,例如在纤维束(FT)中髓鞘碱性蛋白(MBP)的下调,这与 AD 中脱髓鞘的报道一致;在海马体中,谷胱甘肽 S-转移酶 Mu1(GSTM1)的下调也与已知的疾病风险因素相吻合。
更引人注目的是,STRING 蛋白互作网络分析发现,在 5xFAD 小鼠的纤维束和海马体中,有一系列线粒体代谢相关蛋白同步下调,包括线粒体融合蛋白 2(MFN2)、短链烯酰-CoA 水合酶 1(ECHS1)等,而动力相关蛋白 1(DNM1L)则上调,提示线粒体动态和代谢功能在 AD 中发生紊乱。后续的免疫荧光、活体线粒体染料染色以及透射电镜分析均证实,在 2 月龄(疾病早期)的 5xFAD 小鼠脑中,就已出现线粒体的显著肿胀和融合。
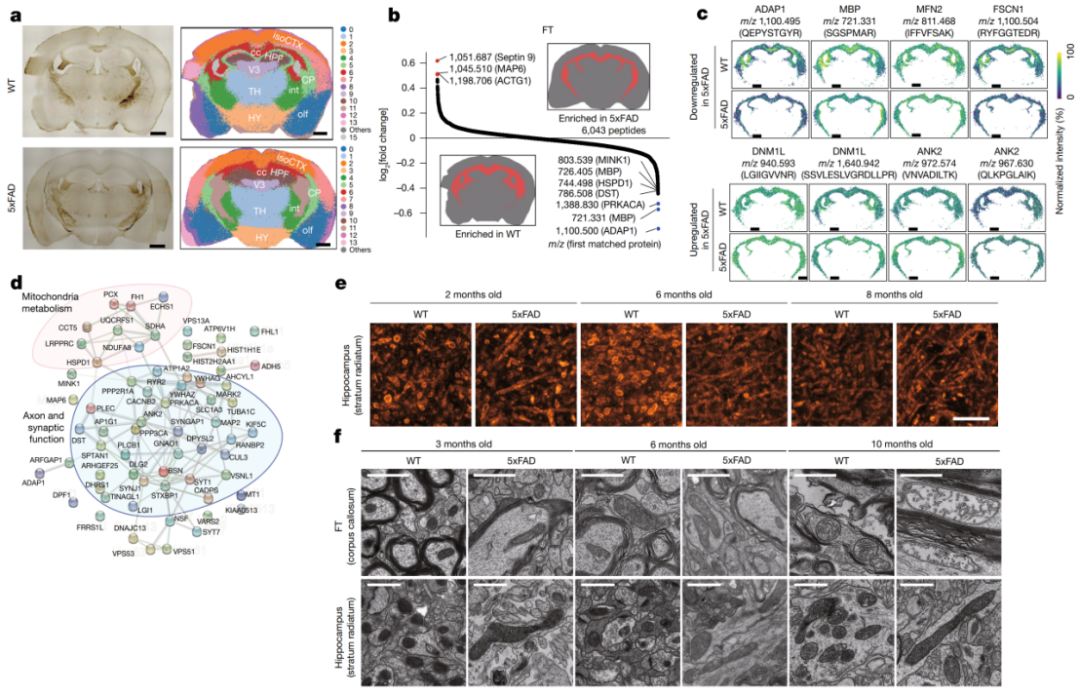
图 4
这一发现促使研究者对 2 月龄的早期病变小鼠脑进行 iPEX 分析。结果发现,过氧化物酶体乙酰-CoA 酰基转移酶 1(ACAA1)在多个脑区,尤其是纤维束和海马体中,出现了显著的早期下调。一例家族性遗传学研究曾发现,ACAA1 的硫解酶功能缺失突变体 N392S 是该汉族谱系早发性家族性 AD 的强风险因子。iPEX 的空间定位能力,首次在动物模型中原位捕捉到了这一关键蛋白的早期变化。
五、 ACAA1 缺失如何驱动神经退行?—— 脂代谢紊乱是关键
ACAA1 是过氧化物酶体中脂肪酸 β-氧化最后一步的关键酶,负责将超长链多不饱和脂肪酸(VLC-PUFA,如 C24:6)转化为对神经功能至关重要的长链多不饱和脂肪酸(LC-PUFA,如 DHA,C22:6)。
为了探究 ACAA1 下调的功能后果,研究团队在 ACAA1 敲除的人源胶质瘤细胞 U251 MG 和诱导多能干细胞(iPSC)及其分化的谷氨酸能神经元、皮质神经元和微胶质细胞中进行了系统的脂质组学分析。
结果发现(图 5):
ACAA1 缺失会导致 LC-PUFA(如 DHA, C22:6)水平显著下降,而其前体 VLC-PUFA(如 C24:6)则发生累积。
这种「retroconversion」(逆向转化)障碍进一步导致细胞膜上富含 LC-PUFA 的磷脂(如 PE, PC)水平降低。
在 ACAA1 敲除细胞中回补野生型 ACAA1 可以恢复正常的脂质谱,但回补 AD 相关的 N392S 突变体或催化结构域截短的突变体则无法实现挽救。
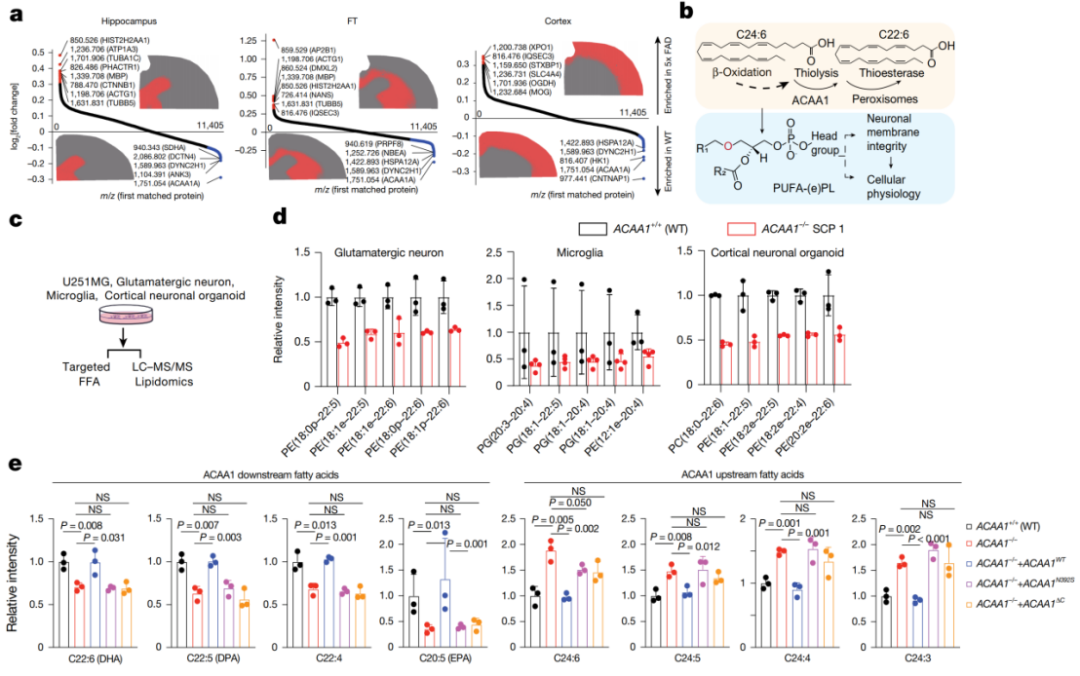
图 5
这些结果清晰地表明,ACAA1 通过其硫解酶活性,在维持大脑 LC-PUFA(尤其是 DHA)稳态中发挥着核心作用。而 DHA 是神经元膜磷脂的关键成分,对突触可塑性、信号转导和神经炎症调节至关重要。因此,在 AD 早期出现的 ACAA1 下调,可能通过破坏神经元膜的脂质组成和功能,进而促成神经退行性病变的发生。
六、 总结与展望
iPEX 技术的成功开发,是空间组学领域一个重要进展。它不仅初步解决了长期困扰该领域的分辨率与灵敏度难以兼得的核心矛盾,更以其广泛的组织适用性和高鲁棒性,为生物医学研究开辟了新的道路。
其技术优势可能源于:
物理放大:直接突破激光扫描移动精度及光斑直径决定的仪器硬件分辨率极限。
分子去拥挤:组织膨胀稀释了与小分子代谢物等离子的竞争,提升了肽段的电离效率。
酶解效率提升:膨胀后更大的表面积提高了蛋白酶与底物的接触效率。
扩散限制:致密的水凝胶网络有效限制了肽段的扩散,保持了空间保真度。
展望未来,iPEX 在以下方面具有巨大应用潜力:
发现生物学:无偏地发现新的细胞类型、状态或疾病特异性生物标志物。
精细结构研究:研究以往难以分离的结构,如轴突、突触、免疫突触等。
微环境分析:绘制肿瘤微环境、组织发育等过程中的蛋白质空间互作网络。
多组学整合:与空间转录组、代谢组等技术结合,提供更全面的分子视角。
当然,iPEX 也面临一些挑战,例如目前对蛋白质的注释仍需依赖 LC-MS/MS 谱图库,且流程对 FFPE 样本的兼容性有待进一步优化。随着组织膨胀技术和质谱成像硬件软件的持续革新,特别是与 MS/MS 兼容模式的整合,iPEX 技术将愈发强大。
西湖大学团队的这项工作,为生命科学与医学研究提供了具备实用性的非靶向空间蛋白质组学平台,使研究人员能够在微米尺度、无偏地观察成百上千种蛋白质在复杂组织中的定位。同时,通过对 AD 模型的深入研究,将 ACAA1 介导的 LC-PUFA 生物合成障碍推到了神经退行早期事件的舞台,为理解 AD 病理机制和开发早期干预策略提供了全新的科学线索。
该研究由西湖大学团队独立完成。西湖多维动态代谢组学核心实验室主任邹贻龙博士和西湖大学 Kiry D.Piatkevich 博士为本文的共同通讯作者;西湖大学生命科学学院博士生王凤翔、孙翠骥以及吴天舒为本文的共同第一作者。
研究过程中,西湖大学刘晓东团队提供多能干细胞诱导的脑部细胞模型支持,西湖大学生物医学实验技术中心质谱与代谢组学平台提供质谱设备支持、高性能计算中心提供大数据分析支撑以及实验动物中心提供了多项技术支持。本研究得到国家科技部重点研发计划、浙江省「尖兵」&「领雁」项目、西湖大学未来产业研究中心、国家自然科学基金面上项目、国家自然科学基金青年学生项目(博士生)、西湖教育基金会和西湖实验室的经费支持。
原文链接:
https://www.nature.com/articles/s41586-025-09734-0
如需代发文章宣传、新闻稿、招聘等,请后台回复【学术】添加小编
我们长期为科研用户提供前沿资讯、实验方法、选品推荐等服务,并且组建了 70 多个不同领域的专业交流群,覆盖神经科学、肿瘤免疫、基因编辑、外泌体、类器官等领域,定期分享实验干货、文献解读等活动。
添加实验菌企微,回复【】中的序号,即可领取对应的资料包哦~
【2401】论文写作干货资料(100 页)
【2402】国内重点实验室分子生物学实验方法汇总(60 页)
【2403】2024 最新最全影响因子(20000+ 期刊目录)
【2404】免疫学信号通路手册
【2405】PCR 实验 protocol 汇总
【2406】免疫荧光实验 protocol 合集
【2407】细胞培养手册
【2408】蛋白纯化实验手册
【2501】染色体分析方法汇总
【2502】国自然中标标书模板
【2503】WB 实验详解及常见问题解答
【2504】DeepSeek 论文写作常用口令
【2505】中国科学院期刊分区表(2025 年最新版)
【2506】期刊影响因子(2025 年最新版)
【2507】130 种实验室常用试剂配制方法(附全套资料)
【2508】常见信号通路
【2509】限制性核酸内切酶大全