19kd的蛋白跑WB出现的条带位置和形状不对
月夜踏马
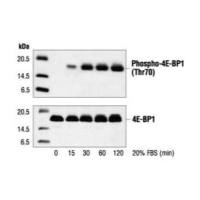
各位战友,快急哭了,实验验证阶段,我跑的蛋白分子量是19kd,跑了好几次WB,曝光15-30s才能出现条带,条带的形状都很丑,而且位置在30-35kd之间。请问是什么问题?是杂带,还是胶的问题,还是抗体的问题?
我的条件是:12.5%雅酶的胶(最后一张图是10%的胶跑的)。
电泳液(1g SDS,3g Tris,14.4g甘氨酸),电泳条件是先90V,等跑到分离胶并且marker跑开后转成120V跑到底。
转膜是90V转90分钟
5%牛奶封闭1-2h
一抗过夜(可达到12-15h),一抗洗膜1小时,二抗孵育1-2小时,二抗洗膜2小时



4 个回答
郭郭求祥瑞
我也觉得胶有问题,但是下边没有目的条带,会不会是因为三明治结构没有那么紧,可以考虑多加一层白膜,我跑19kd的时候都是用的15%%的
月夜踏马![]()
你好,那能麻烦你说一下你是怎么制胶的吗?我比对下,这两个多星期来跑的WB都是这个结果,很崩溃!谢谢!
我们实验室目前有用两种胶,一种是雅酶公司的,一种是诺唯赞公司的,我最近在用12.5的胶,配置方法:分离胶配法是8ml下层胶溶液+8ml下层胶缓冲液+160ul促凝剂,浓缩胶的配法是3ml上层胶溶液+3ml上层胶缓冲液+60ul促凝剂。(多配的,实际制胶的时候会剩一点)
土井挞克树
看着像胶的问题,一般微笑影和胶或者电泳槽偏离有关
麻黄连翘赤小豆
可能是胶的问题,还有蛋白是不是有点降解了,电泳的时候不能跑太快
月夜踏马![]()
应该不是蛋白降解的问题,我都是用的新提的蛋白,而且两个批次的蛋白都这样。
电泳的速度是先90V,到分离胶后Marker跑开,我调成120V。
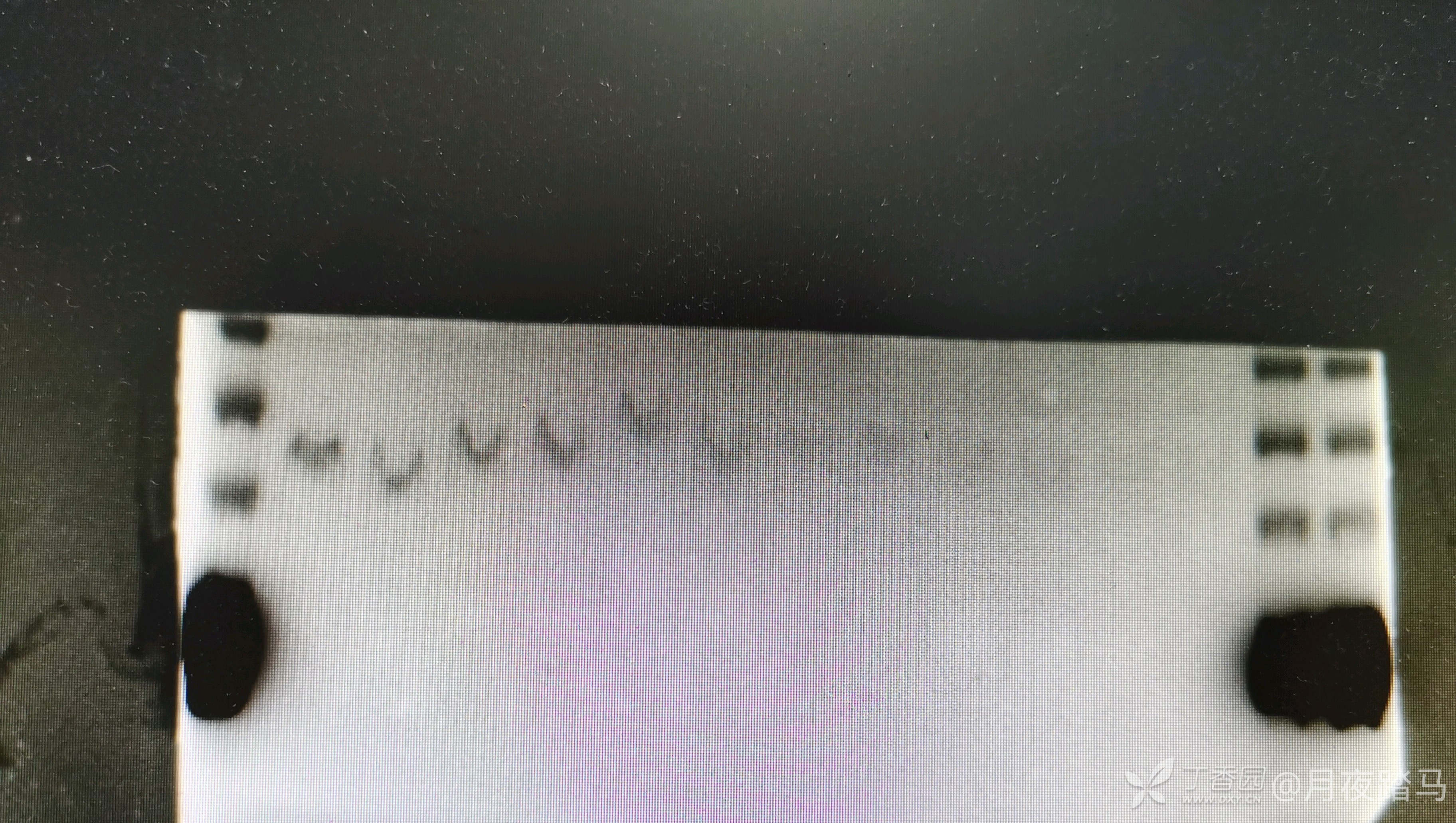
12.5的胶跑到下面的时候,会发现25、15和10的指示剂条带高度很宽,甚至有点弥散的样子。然后转膜之后就可以看到PVDF膜上有色素残留,尤其是15kd-25kd的位置比较明显,且每个泳道都有色素残留。
这种现象并非偶然一次。
谢谢回答!
申东熙老伯
条带这个形状显然跑胶的时候就有问题,你的电泳槽下面是不是锈了,以及既然条带小,就不要电泳太久,和预计条带大小有区别很正常。
月夜踏马![]()
感谢你的解答。我们实验室目前有用两种胶,一种是雅酶公司的,一种是诺唯赞公司的,我最近也都在用12.5的胶,配置方法:分离胶配法是8ml下层胶溶液+8ml下层胶缓冲液+160ul促凝剂,浓缩胶的配法是3ml上层胶溶液+3ml上层胶缓冲液+60ul促凝剂。(多配的,实际制胶的时候会剩一点)
而且每次转膜结束,我会发现膜上会残留一部分色素,粉红色的那种,越靠下越明显。
相关产品推荐