wb 条带异常问题的出现原因?
兀自前行
Western Blot是一种常用的检测细胞蛋白表达的实验技术,虽然很基础,但是实验步骤繁琐。中间某步骤出问题就会但是出现各种各样的条带异常,有没有大神分析下不同异常条带出现的原因?
3 个回答
dxy_gwrp7ndq
1、阴性结果的原因
1) 二抗条件过低:提高二抗浓度、延长二抗孵育时间或孵育温度
2) 一抗条件过低:提高一抗浓度、延长一抗孵育时间或孵育温度
3) 抗原过少:提高上样量
4) 抗体种属不兼容:一抗species reactivity中是否有需要检测样品的种属来源,一抗与二抗是否相匹配
5) 酶活性:二抗上标记的HRP或AP等酶活性降低,如抗体过期或反复化冻等
6) 封闭过度或封闭剂不兼容:降低封闭剂浓度、缩短封闭时间,或者更换封闭剂种类
7) 底物出现质量问题:可以通过点杂交试验排除底物和酶活性问题
8) 抗体稀释液pH:注意检测pH是否在6-8
9)样品不表达该目的蛋白
10)转膜不足或过头:优化转膜条件
2、有杂带或背景的原因
1)目的蛋白有多个修饰位点,本身可以呈现多条带,建议查阅文献或进行生物信息学分析,获得蛋白序列的修饰位点信息,通过去修饰确定蛋白实际大小
2) 样本处理过程中目的蛋白发生降解,建议加入蛋白酶抑制剂;样本处理时在冰上操作
3)二聚体或多聚体存在,建议增加蛋白质变性过程及强度
4)上样量过高:降低上样量,减少抗原含量
5)二抗条件过强:降低二抗浓度、缩短二抗孵育时间或改变温度等
4、蛋白条带位置(大小)不对
1)胶浓度不对,不同浓度的胶跑出的蛋白条带的位置可能有所偏差,可以调整浓度
2)抗体孵育不充分,建议增加抗体浓度,延长孵育时间
3)酶失活,建议直接将酶和底物进行混合,如果不显色则说明酶失活了。选择在有效期内、有活性的酶联物
4)目的蛋白存在翻译后修饰或剪切体,建议查询相关文献确定
5)标本中不含靶蛋白或靶蛋白含量太低,建议设置阳性对照比对结果,增加标本上样量
5、背景有黑色斑点或不均匀的白色斑点和暗背景上白色带
1)抗体与封闭试剂反应,建议使用前过滤封闭试剂
2)HRP含量过高,建议降低酶联二抗的浓度
3)HRP偶联二抗中有聚集体,建议过滤二抗试剂,去除聚集体
4)抗体分布不均匀,建议孵育抗体时使用摇床
6、为什么我的细胞提取液中没有检测到目的蛋白
1)细胞中不表达这种蛋白质,换一种细胞
2)抗体不能识别目标蛋白,多看看说明,是否有问题
3)可能是没有保持低温操作,样品保存不当,样品放置时间过长
4)细胞中的蛋白质被酶降解掉了,可加入蛋白酶抑制剂,抑制蛋白酶活性
7、我的目的带很弱,如何加强
1)可以加大抗原上样量,这是最主要的
2)也可以将一抗稀释比例降低
3)还可以延长曝光时间
府宅
1、高背景
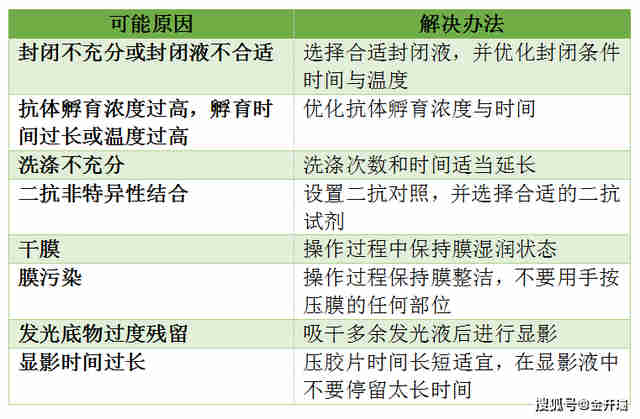
2、无目的条带

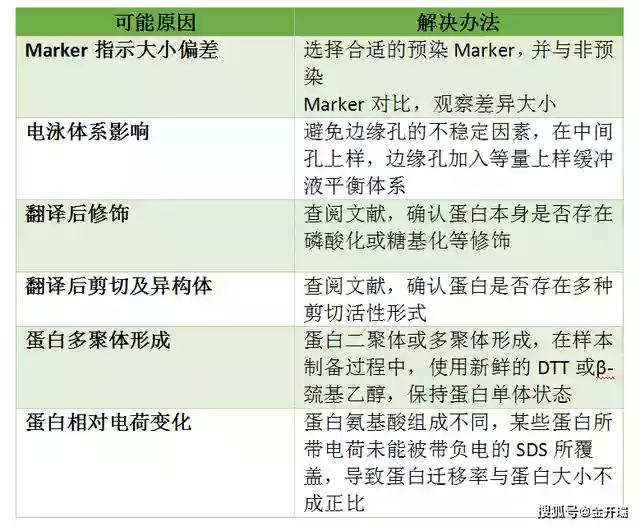
3、条带大小与理论值位置不符
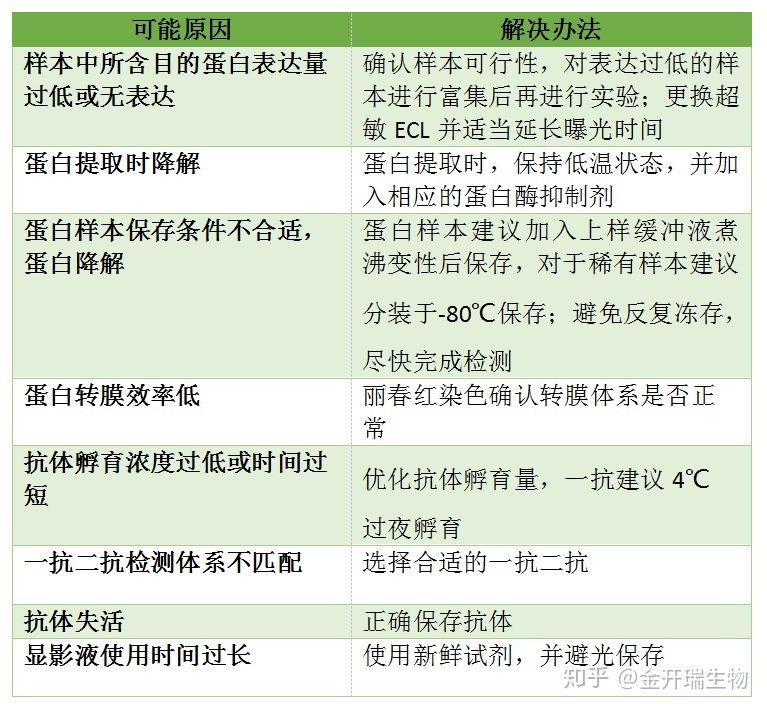
4、其它问题
小布丁瑶瑶
1. 啥也没有
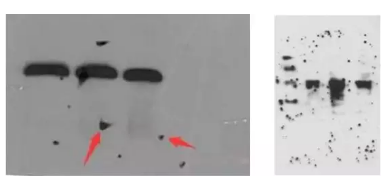
原因:比较多,如果单纯一张没有任何显色的X光片,最可能是一抗加成其他抗体,或者二抗种属加错了,比如兔的加成鼠
解决办法:仔细检查抗体是否加错,确认转膜没有问题。
经验:上面的图片展示的是一点信号都没有,如果是这样大部分情况是抗体加错了。如果中间出现了细微的条带,可能原因是蛋白上样量太少,一抗浓度过低,ECL发光液失效。另外如果转膜出现了问题,比如膜放反了,自然是一个白片。
2. 高背景
原因:封闭不够好,一抗浓度高,洗膜时间和次数不够
解决办法:降低一抗浓度,增加洗膜时间和次数。
经验:高背景可能是WB中最常见出现的问题,目的条带单一清晰,但是其他地方又弥漫性较为均一的背景(比较连续的)。其实只要我们注意操作规范,不偷工减料就很容易避免,洗膜按照规定来5miundefined5次或者10miundefined3次,不要改成5miundefined3次,或者10miundefined2次。
3. 非特异性条带
原因:一抗非特异性与蛋白结合
解决办法:更换一抗
经验:此种情况绝大多数是因为一抗不好,你无法判断那一条是目的条带。如果实在没有更好的抗体,建议采用阴性对照和阳性对照来确定上述哪个条带是目的条带。当然这种情况下有一种很小几率的可能是一抗浓度太高引起的非特异性结合。
4. 条带中出现边缘规则的白圈
原因:电转中膜和胶之间存在气泡。
解决办法:转膜前去掉膜和胶之间的气泡
经验:我们常常将电转液倒入一个盘子里,倒入的液体不能太多也不能太少,最好的高度是与放上第一层滤纸齐平,然后往滤纸上浇点转膜液,把电泳胶用清水清洗下,将电泳胶平铺到滤纸上,仔细检查滤纸与胶之间是否有气泡,可以左右前后观察,不同方向观察之后确认无气泡,然后再往胶上面浇点电转液,用两只手的拇指和食指轻轻夹住PVDF膜的两侧中间,使膜成U型,然后将U型的底部接触胶的中间,慢慢往两边放下膜,这样一般气泡很少。然后上层滤纸同样用U型的放置方法,用玻璃棒稍微贴实下,然后盖上海绵。注意不要来回赶气泡,这样反而会带入气泡。
5. 条带中间出现白色(反白)
原因:中心部位高浓度HRP把底物消耗过快,中间部位底物消耗结束之后就不发光了
解决办法:降低蛋白量,降低一抗和二抗的浓度。
经验:如果你足够迅速,可以在中间部位底物消耗之前就把X光片给定影出来,但是时间很难把握,建议还是从降低蛋白量,降低一抗二抗浓度入手。