一、饲养环境小鼠对环境的适应性的自体调节能力和疾病抗御能力较其他实验动物差,而小鼠的品种和品系繁多,各个品种和品系都有自己的特殊要求,因此必须根据实际情况给予一个清洁舒适的生活环境。不同等级的小鼠应生活在相应的设施中。小鼠临界温度为低温 10℃,高温 37℃,温度中性范围 30~33℃。饲养环境控制应达到如下要求:温度 18~29℃;相对湿度 40~70%;最好控制在 18~22℃,湿度 50~60%。一般小鼠饲养盒内温度比环境高 1~2℃,湿度高 5~10%。要保持温度、湿度相对稳定,日温差不超过 3℃,否则会直接影响小鼠的生长发育、生产繁殖、甚至导致小鼠发生疾病,从而影响实验结果。温湿度的相对稳定对于建筑条件较差的地方可用空气调节器、加湿器、在北方用暖气进行调节。为了保持室内空气新鲜,氨浓度不超过20ppm,换气次数应达到 10~20次/小时。现在我国普遍采用无毒塑料鼠盒,不锈钢丝笼盖,金属笼架。笼架一般可移动,并可经受多种方法消毒灭菌。用清洁层流架小环境控制饲养二、三级小鼠不失为一种较好的方法。笼盒既要保证小鼠有活动的空间,又要阻止其啃咬磨牙咬破鼠盒逃逸,便于清洗消毒。带滤帽的笼
一、小鼠的行为和习性1. 小鼠胆小,易于受惊,对外界环境的改变反应敏感。受惊时,尾巴挺直并猛力甩动,如强光或噪声刺激可导致哺乳母鼠神经紊乱,发生食仔现象。2. 小鼠在人工驯养条件下,性情温顺易于捕捉,一旦逃出笼外过夜则恢复野性,行动敏捷难以捕捉。3. 小鼠喜欢阴暗,固定一处睡眠营巢。傍晚活动加强,夜间更加活跃, 其进食、交配、分娩多发生在夜间。4. 小鼠是典型的啮齿动物,门齿终生生长。因此小鼠有啃咬习惯, 以此来磨损门齿并保持其长短的恒定。5. 小鼠为群居动物,当群饲时,其饲料消耗量比单个饲养时多,生长发育也快。6. 小鼠群体中性成熟的雄鼠放在一起易发生互斗。 源于一窝的雄鼠或断奶后同笼饲养的雄鼠间则较少攻击。外来雄鼠常招致几只雄鼠的集体攻击。群居优势在雄性很明显,表现为群体中处于优势者保留胡须,被称为“理发师”,而处于劣势者胡须被拔光。这一现象应与因寄生虫性或真菌性皮炎所致的掉毛相区别。雄鼠具有分泌醋酸胺臭气的特性,是小鼠饲养室内特异臭气的主要原因。7. 小鼠对外界温度的变化特别是低温非常敏感,由于运输、 环境改变而致低温可很快引起小鼠死亡。 二、解剖学特点1. 外观小鼠体形小,90
环状RNA(circRNA)是一类特殊的非编码RNA分子,也是RNA领域的研究热点。circRNA分子呈封闭环状结构,不受RNA外切酶影响,表达更稳定,不易降解。circRNA分子富含microRNA(miRNA)结合位点,在细胞中充当miRNA分子海绵(miRNA sponge),可以解除miRNA对其靶基因的抑制作用。在circRNA的研究中,设计出特异的circRNA引物极为关键。以下简介在circRNA的研究中,如何准确快速获得感兴趣circRNA序列并设计对应的环状RNA引物。一、序列查询如果已经知道circRNA的数据库ID,可以在circRNA数据库如:circBase中进行查找:1.首先,进入circBase主页,http://circbase.org/,输入circRNA的ID。 2.点击Search,进入搜索结果,在结果界面中提供了circRNA的种属、染色体位置、ID、基因组中序列长度、剪接后RNA长度、文献等相关信息,点击FASTA3.进入如下界面,选择spliced后点击最下方的search键。4.即可下载FASTA格式的circRNA序列,下载的文件可以用记
导读今年4月,《molecular Cell》杂志上刊登了一篇基于高通量测序方法研究肌细胞分化过程中circRNA功能性文章。通过RNA-Seq筛选人和老鼠(C2C12)肌母细胞(myoblasts )分化成肌管细胞(myotubes )过程以及肌营养不良症(DMD)状态下差异表达的circRNA,然后利用RNA干扰(RNAi)技术找到在肌肉分化过程中起作用的circRNA。更有趣的是,作者发现其中一个circRNA序列中含有开放阅读框(ORF),从而又进一步证明其具有编码蛋白的能力。由于文章内容充实丰富,小编决定分两次给大家详细解读,本次重点阐述高通量数据分析部分。 一、样本介绍本文所研究的样本是人和小鼠(C2C12)的肌母细胞(myoblasts ,GM)以及诱导分化后的肌管细胞(myotubes ,DM),每个样本有A,B两个重复进行RNA-Seq(在circRNA进行差异表达分析中,作者还用到了人肌营养不良(DMD)样本)。作者采用FindCirc软件流程检测circRNA,结果如下表:表1 Number of detected linear and circular spli
一、 什么是DNA甲基化在甲基转移酶的催化下,DNA的CG两个核苷酸的胞嘧啶被选择性地添加甲基,形成5-甲基胞嘧啶,这常见于基因的5'-CG-3'序列。大多数脊椎动物基因组DNA都有少量的甲基化胞嘧啶,主要集中在基因5'端的非编码区,并成簇存在。甲基化位点可随DNA的复制而遗传,?因为DNA复制后,甲基化酶可将新合成的未甲基化的位点进行甲基化。DNA 甲基化是表观遗传学的重要部分,同组蛋白修饰相互作用,通过改变染色质结构,调控基因表达。在哺乳类细胞或人体细胞中,DNA 甲基化与细胞的增殖、衰老、癌变等生命现象有着重大关系。二、 DNMT(DNA甲基转移酶)对催化DNA 甲基化的DNA 甲基转移酶(DNAmethyltransferase, Dnmt)的研究可以揭示DNA 甲基化对基因表达调控的机制,从而研究与之相关的重要生命活动。DNA 甲基转移酶有两种: 1) DNM T1, 持续性DNA 甲基转移酶—— 作用于仅有一条链甲基化的DNA 双链, 使其完全甲基化, 可参与DNA 复制双链中的新合成链的甲基化,DNMT1 可能直接与HDAC (组蛋白去乙酰基转移酶) 联合作用阻断转录;
2.2.10 DNA微阵列法Yan等2001年[40]将以分子杂交为基础的微阵列技术应用于DNA甲基化检测中,这种方法是基于杂交的寡核苷酸微阵列,是一种在基因组中寻找新位点的方法。包括用于整个基因组范围内扫描的差异甲基化(DMH)杂交(Huang等1999年[41])和用于检测某个位点的甲基化特异性微阵列MSO(Gitan等2002年[42])。前者类似于mRNA表达谱或cDNA微阵列,是CpG岛微阵列,后者类似于寡核苷酸微阵列,是针对CpG二核苷酸位点的甲基化特异性寡核苷酸微阵列[26]。MSO要求预先设计一对含有2个不相邻的GC(或AC)的探针,用于识别甲基化和非甲基化的序列,其中含GC的探针(5[42]'---GC---GC---3')识别甲基化序列,含AC的探针(5'---AC---AC---3')识别非甲基化序列,探针的5'端通过Linker固定于玻璃板上。首先对待研究片段用重亚硫酸盐处理,将非甲基化的胞嘧啶变为尿嘧啶,甲基化的不变,再行PCR扩增,产物的3'端用荧光素标记,移至连有探针的玻璃板上进行杂交,通过检测杂交后产生的荧光强度判断待测序列中甲基化的水平。此方法一定要设
摘要: DNA甲基化是表观遗传学(Epigenetics)的重要组成部分,在维持正常细胞功能、遗传印记、胚胎发育以及人类肿瘤发生中起着重要作用,是目前新的研究热点之一。随着对甲基化研究的不断深入,各种各样甲基化检测方法被开发出来以满足不同类型研究的要求。这些方法概括起来可分为三类:基因组整体水平的甲基化检测、基因特异位点甲基化的检测和新甲基化位点的寻找。本篇将主要介绍目前存在的大部分DNA甲基化研究方法,并对其相关特性进行了简要分析与总结。关键词:表观遗传学;DNA甲基化;甲基化研究方法早在1942年,C.H.Waddington首次提出表观遗传学(epigenetics)的概念,并指出表观遗传与遗传是相对的,它主要研究基因型和表型的关系。几十年后,霍利迪(R. Holiday)针对表观遗传学提出了更新的系统性论断,也就是人们现在比较统一的认识[1],即在不改变基因组序列的前提下,通过DNA和组蛋白的修饰来调控基因表达,这种修饰以DNA甲基化最为常见。继人类基因组计划结束后,2003年人类表观基因组协会(Human Epigenome Consortium, HEC)宣布开始投资和实施
1.生物磁珠具有小尺寸效应和表面效应,能够用高效DNA提取,满足微量生物样本DNA提取的要求。 2.磁珠表面能够进行化学修饰,从而与DNA进行特异性吸附,去除样品DNA溶液中的抑制物质,如:有机溶剂、去污剂、金属离子、燃料等。 3.生物磁珠表面功能团数量可以控制获得可提取DNA溶液的浓度信息,实现定量的要求。 4.生物磁珠可以通过特殊的合成工艺使其具有超顺磁特性,因此,能够通过仪器进行自动化操作,满足数据库建设对大批量样本提取的需要,减少人为因素。 5.用时少,操作简单,是用于大多数生物检材。 6.低廉,便于广泛应用。由于纳米生物磁珠合成采用的都是低价无机和有机原料。无须特殊的仪器设备,使得最终的合成和研发成本都很便宜,适合于我国的基本国情和经济现状。 7.适应了建立DNA数据库所需的大量生物样本的提取,为我国DNA数据库的建设铺平了道路,打下了基础。与传统提取DNA法相比速度更快!纯度更高!一般情况下不需离心操作,单一样品多应在1h内提取完毕。对全血、骨骼、植物等提取DNA在不pcr扩增的情况下能在凝胶电泳中看到较为明亮的条带。
染色质免疫沉淀(Chromatin Immunoprecipitation, ChIP)是研究体内(划重点鸭,体内)蛋白质与DNA相互作用的一种技术。它利用抗原抗体反应的特异性,可以真实地反映体内蛋白因子与基因组DNA结合的状况。可应用于组蛋白修饰、DNA复制与损伤相关因子结合分析、干细胞调控转录因子及辅因子等基因表达机制的广泛研究。 最近有做chIP的朋友来找我们咨询:为什么我的ChIP实验做出来,结果就是不理想呢?为得到理想的ChIP结果,可以做以下实验条件优化: 1、 染色质的制备:为了获得足量的染色质,我们的样品准备一定要充足。(IP实验的损耗较大,为保证实验用量,一次准备5×10E7个以上细胞较好) 2、 优化交联固定条件:ChIP实验成功与否,直接取决于染色质完整性、抗原表位质量和抗体特异性(抗体一定买好的)。因此优化交联固定条件,富集丰度更高。 3、 优化染色质片段化条件:要得到理想的ChIP结果,合适长度和浓度的染色质样品至关重要。(推荐的片段化程度为的染色质片段在150-900bp之间)。 4、 免疫沉淀优化:在ChIP抗体富集优化实验中,使用过多或过少抗体对ChIP
我们在设计pcr引物的时候,经常需要将设计好的正反向引物与基因组DNA序列进行比对验证,但是因为反向引物是反向互补的,所以有些麻烦。因此,在这里介绍两个非常的小工具,一个是在线的模拟PCR,一个是本地运行的程序包,我会以附件形式上传,不需要丁当即可下载。两个都写得非常详细,相信大家都能看懂。不知道这个帖子能不能加分?希望版主看到后给予加分奖励方法一:UCSC中的In-Silico PCR1、登录UCSC,网址链接http://www.genome.ucsc.edu/index.html,点击右侧工具的In-Silico PCR,或者在Tools下拉框中点击In-Silico PCR,如下所示:2、点击In-Silico PCR后,出现如下界面,我们需要将自己设计好的正向引物和反向引物分别粘贴至各自空白框,点击submit。对其它几个参数做点说明吧,Max Product Size是指被放大区域的最大长度,Min Perfect Match是指和引物的3‘末端Perfect Match的最小碱基数目,Min Good Match: 是指和引物的3‘末端Good Match的最小碱基数目,
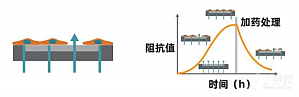
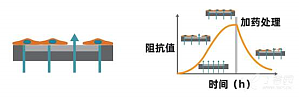
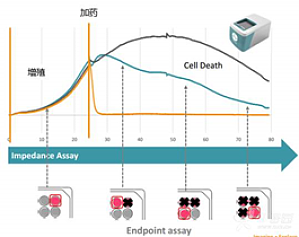
基本原理:将细胞样本置于阻抗板中(底部埋入电极的96孔培养板)进行培养,当细胞贴附于电极并伸展开后,将微小的电信号施加于电极上,细胞间形成的联接将阻挡这些电信号的通过,导致阻抗值的读数增加,而细胞结构形态上的细微改变(比如源于受体介导的信号传递或细胞形态学变化)也会影响阻抗值。也就是说,细胞的贴壁、黏附、增殖及形变等过程都会引起阻抗的变化,细胞的增殖数量与阻抗呈现一个正相关的关系。阻抗检测会计算有多少电信号(上图 ...
Maestro Z基本原理:将细胞样本置于阻抗板中(底部埋入电极的96孔培养板)进行培养,当细胞贴附于电极并伸展开后,将微小的电信号施加于电极上,细胞间形成的联接将阻挡这些电信号的通过,导致阻抗值的读数增加,而细胞结构形态上的细微改变(比如源于受体介导的信号传递或细胞形态学变化)也会影响阻抗值。也就是说,细胞的贴壁、黏附、增殖及形变等过程都会引起阻抗的变化,细胞的增殖数量与阻抗呈现一个正相关的关系。阻抗检测会计算有多 ...
基本原理:将细胞样本置于CytoView-Z阻抗板中(底部埋入电极的96孔培养板)进行培养,当细胞贴附于电极并伸展开后,将微小的电信号施加于电极上,细胞间形成的联接将阻挡这些电信号的通过,导致阻抗值的读数增加,而细胞结构形态上的细微改变(比如源于受体介导的信号传递或细胞形态学变化)也会影响阻抗值。也就是说,细胞的贴壁、黏附、增殖及形变等过程都会引起阻抗的变化,细胞的增殖数量与阻抗呈现一个正相关的关系。阻抗检测会计 ...
背景介绍 加州理工大学的Kiichi Watanabe在先前的研究中发现,ROCK(Rho-associated Coiled-coil-forming protein serine/threonine Kinase)通路的抑制剂Y-27632能够改善人源胚胎干细胞(hESCs)的生存状态,抑制细胞凋亡。目前,Y-27632已经被广泛运用应用于优化人源干细胞的培养。可惜的是,Y-27632对于细胞活力及生存率提升有限,我们仍然需要找寻更高 ...
中华人民共和国国务院令第727号《化妆品监督管理条例》在2020年1月3日国务院第77次常务会议通过,自2021年1月1日起施行。《化妆品监督管理条例》中第七十七条规定:牙膏参照本条例有关普通化妆品的规定进行管理。根据法规要求,是不是意味着牙膏成为了化妆品呢?在2021年1月14日国家药监局召开的化妆品监管条例实施新闻吹风会上,国家药监局化妆品监管司副司长戚柳彬对“牙膏参照有关普通化妆品的规定进行管理是基于什么考虑”这个问题进行了回答。其中提到牙膏在原料管理、标签管理上有区别于普通化妆品的独特之处,因此条例规定是“参照”而不是“按照”普通化妆品进行管理。下一步,国家药监局将按照条例规定要求,充分尊重牙膏监管的自身规律,在考虑行业发展现状、历史沿革的前提下,严格落实“四个最严”要求,推进相关配套规章和规范性文件的起草工作。国家药监局化妆品监管司为贯彻落实《化妆品监督管理条例》,组织起草了《牙膏备案资料规范》(征求意见稿),向社会公开征求意见并于2021年1月5日发布了关于公开征求《牙膏备案资料规范》法规文件意见的函。征求意见稿中对牙膏备案提交资料和备案检验要求进行了明确规定。2021年1
本人现在正在做线栓法大鼠大脑中动脉阻断实验(MCAO模型),这方面的资料我查了一些,这个实验我也作了一段时间,不敢说很专业了,不过现在基本上我能在15min左右完成手术,而且手术过程中不出一滴血,造模后缺血程度基本一致。虽然前面有很多前辈发了很多MCAO的很专业的贴子,不过我觉得比较凌乱,现在我把我的心得体会和以前的贴子的精华部分奉献给大家,希望这会对将要做这个实验的朋友有一丝的帮助。虽然做实验总会有郁闷的时候,不过风雨之后总会见到彩虹的,这可以也是我的心得体会。衷心祝福大家能把实验做的成功、完美! 实验前准备 麻醉剂:水合氯醛(应较好的控制大鼠体温) 保温:60W白炙灯高度为37cm直接照射能使肛温保持在 37℃ 栓线的制备:1.取熔点为56℃的固体石蜡一块,在瓷杯中加热熔化。直径为o.24mm、长5cm的鱼线一端5mm长的一段,垂直在熔化的石蜡中迅速浸入并提起,立即凝固的一薄层石蜡可牢固地粘附在鱼线一端的表面,其直径为0.26mm。就这样,普通的鱼线即可变成规相一致头端光滑圆钝的栓线。 2.在鱼线18mm的位置用涂改液标记一个白色点。 TTC的配制:用0.2mol/L磷酸缓冲液(P
糖尿病(diabetes mellitus ,DM)已成为严重危害人类健康的公共卫生问题。DM 及其并发症不仅严重影响糖尿病患者的生活质量,同时也是致残、致死的重要原因。因此,建立合适的糖尿病动物模型,阐明 DM 及其并发症的发病机制就显得尤为重要。目前,DM 动物模型制备方法主要有:手术切除胰腺、化学药物诱导、自发性糖尿病动物模型、转基因动物等。 一、切除胰腺的 DM 模型常采用狗、猫和大鼠等造模,全部或大部分切除实验动物的胰腺,但保存胰十二指肠动脉吻合弓。如果连续两天血糖值超过 11.1mmol/L或者葡萄糖耐量试验 120min 时的血糖值仍未恢复到注射前水平则认为 DM 造模成功。其机制是全部或大部分切除胰腺后,β细胞缺失而产生永久性 DM。 二、化学药物诱发的 DM 模型采用链脲佐菌素腹腔注射或四氧嘧啶静脉注射可诱发 DM,常用动物有小鼠、大鼠、家兔和狗。链脲佐菌素(streptozotocin STZ)的参考剂量为 50~150mg/kg;四氧嘧啶(alloxan)的参考剂量为 60~110mg/kg。STZ 是一种含亚硝基的化合物,进入体内可通过以下机制特异性地破坏胰岛β
肿瘤模型我们一般常用的就是小鼠模型和人肿瘤裸小鼠移植瘤模型。其中用得最多的是皮下模型,另外还有腹水(或者尾静脉注射)以及原位模型,其他的模型很少用,就不提他们了。小鼠模型分三大类:第一类是以 S180、EAC、H22 等为代表的,他们的宿主小鼠多选用 KM,可产生腹水,也可在皮下成瘤。多以腹水传代,实验时抽取腹水,经过一定稀释后皮下接种构建模型,接踵后第二天开始给药,给药 7 到 10 天,接种 10 天后结束试验,剥取肿瘤称瘤重。 1. 关于构建瘤种可以用体外细胞株培养后,用 PBS 悬浮至 1~3×106/0.1ml/mouse,i.p 接种即可,最好用 6 号左右的针头,就是常用的 2ml 一次性注射的针头。 2. 关于腹水传代观察到第一代的种鼠肚子较大后(一般约 8~9 天左右),可以传代,传代时取 1ml 注射器,用 2ml 注射器的针头,种鼠腹部消毒后直接将针头插入抽取腹水即可,注意不要把针头插得很深,尽量浅一点,还可以把老鼠拎起来,利用重力,让腹水集中在某处便于抽取,一般抽个 0.5ml 就可以了,不用离心。直接用 PBS 3~6 倍稀释后,接种到新的老鼠腹腔,腹水颜色为
裸鼠肿瘤接种一般有细胞接种和瘤块接种两种方式,接种取材有手术活检标本、癌性胸腹水标本和体外培养的细胞系三种。楼主看来是做体外培养的细胞的裸鼠接种,一般用带 6 号针头的注射器取适量细胞悬液注射于裸鼠的皮下,部位看试验要求而定,一般在腋下或背部皮下,每个接种部位注射 0.1-0.2 ml。就是将培养的细胞收集起来调整到适宜浓度重悬于不含血清的培养液或 PBS 中,放于冰盒中携至动物房,直接注射即可。是牵涉到细胞株的成瘤性问题,可以通过增大细胞悬液浓度的办法来解决。一般细胞浓度可在 undefined10 的 6 次方到 undefined10 的 7 次方之间,浓度再大就可能打不进去了。具体浓度需要查相关文献。如果成瘤率太低,可以通过把瘤块在裸鼠身上传 2—3 代的方法提高成瘤率,即将已成瘤鼠的瘤块取出接种于新鼠身上,成瘤后再取出接种新鼠,如此传几代,肿瘤性质稳定后,再将肿瘤取出,剪碎、研磨、匀浆成为细胞悬液后再接种。 一、可移植性肿瘤的建立方法腹水瘤的建立将动物实体瘤细胞注入受体动物腹腔内,或将实体疤移植于受体动物的腹壁内,肿瘤生长后引起腹水,腹水内含高大量瘤细胞可移植传代即为腹水瘤。建议腹水瘤初期、腹水往往是血
一、大鼠灌胃 大鼠灌胃是最常见的给药方法之一。灌胃所用的针头可以从市场上购买,操作方法和小鼠灌胃大同小异,只是由于大鼠体积较大,抓大鼠的手法和小鼠有所不同。 大鼠灌胃是在清醒状态下进行的,不需要麻醉。大鼠的灌胃针长约6~8cm,直径约1.2mm。 大鼠灌胃时,右手持灌胃注射器,左手拇指和食中二指相对,抓住大鼠颈部皮肤,使大鼠的头部和颈部及躯干呈一直线,不需要固定大鼠的尾巴,就可以实施灌胃操作了,其余的操作均和小鼠一样。 大鼠一般灌胃量为1ml/100g体重,因此一般大鼠灌入2ml是可以的。大鼠的灌胃给药体积一般为5~10ml/kg。但是药物的浓度是需要自己按照动物实验方法学的方法进行换算:200g大鼠对应70kg人的折算系数为0.018。 二、大鼠腹腔注射 腹腔注射是常见的给药方式,尤其是在麻醉时。常见的麻醉方法均是麻醉药物腹腔注射。 大鼠腹腔注射的方法和小鼠基本相同。 1.大鼠腹腔注射可以用5ml的注射器,配合5.5~7号针头。 2.腹腔注射时右手持注射器,左手的小指和无名指抓住大鼠的尾巴,另外三个手指抓住大鼠的颈部,使大鼠的头部向下。这样腹腔中的器官就会自然倒向胸部,防止注射器刺入