又是一年毕业季。转眼已是5月底,经过前段时间的日夜奋斗,很多童鞋的毕业论文已经通过了外审,悬着的心放了大半。接下来的事情就是全力准备毕业答辩了。一个集实力与颜值为一体的屁屁提,不对,PPT,毫无疑问能够为你的答辩增色不少。因此,作为一个小小的前辈,笔者就来简要分享一下做出高水平答辩 PPT 的一些要点和技巧,相信对各位小伙伴们一定有所帮助。 不套用模板,借鉴即可有很多的小伙伴会套用网上下载的模板来做答辩 PPT,淘宝上一搜就会有很多模板,比如「学术答辩 PPT 模板 100 套」。尽管使用模板确实可以给我们带来很多方便,但是笔者建议大家在做 PPT 的时候,可以借鉴模板中的排版设计,但不要直接套用。模板虽然看起来十分华丽,有些还会添加酷炫的动画效果,但其实并不适合在较为严肃的毕业答辩场合使用。这些装饰会显得花里胡哨、华而不实,反而会让答辩老师觉得你不够专业,「不是学术该有的模样」。所以小伙伴们一定要记住,制作学术答辩 PPT 的重中之重是清晰直观的展现研究内容。并且就像 SCI 论文作图的要求一样,PPT 中的字体字号、图片排版和文献引用等方面均需符合学术规范。在这些基础上,再通过美化
如何利用 「MeSH 主题词」+「自由词」检索,查全文献? 万事都要举例才能说清,接下来科研君就用一个检索实例来为大家演示 PubMed 数据库检索的实操吧!假设我们要检索的词语是「经颅磁刺激」,英文翻译是「Transcranial magnetic stimulation」,这时候检索小白是怎么做的呢?一般来说 ta 只会打开 PubMed 数据库,在检索框里输入该关键词,然后点击「搜索」,出来的结果 19,918 篇,那科研老司机是怎么做的呢?请继续看!图片来源:PubMed 检索结果页 第一步:建立 MeSH 主题词!进入 PubMed 官网后,先往下拉,找到 「MeSH Database」,点进去后输入关键词「"Transcranial magnetic stimulation"」,再点击「Search」后就能得到我们需要的主题词、副主题词以及自由词。图片来源:PubMed 检索结果页图片来源:PubMed 检索结果页 第二步:将 MeSH 主题词,添加到 PubMed 高级检索页面点击右上角如图所示的输入框,选择「Add to search builder」,然后再点击「Se
一篇文章从写作到发表,往往需要很长时间,这期间包括作者写作准备稿件,以及杂志社处理稿件。大家能掌控的部分就是准备稿件,一方面可以尽早开始写,另一方面缩短写作时间。相对来说,文章一旦写完,就要开始选择合适杂志进行投稿,这一步骤不是自己完全能掌控的。有的杂志处理审稿非常快,大家都会很满意;不过好多杂志处理以及审稿过程非常慢,这会让我们焦躁不安,以至于看到本版太多的网友把稿件处理的状态帖上来,让其他人来帮忙预测接受与否的可能性,说实话,这样做,一点意义没有,纯属浪费时间,还不如早点做些功课,弄清楚相关杂志的审稿处理快慢情况,以至于心中有数。以下是站友分享的几大领域中稿件审稿处理速度最慢的几个杂志和速度相对较快的杂志,以便于后来者参考。 一、审稿速度较快的杂志:International orthopaedics骨科杂志中的迅雷!投稿后不到 1 天就 under review,之后 1 天内收到主编信件,就肯定是被拒!如果超过 1 天就是送外审了。一般审稿时间为 1 个月。International Journal of Molecular Sciences(Int J Mol Sci)挺快。
文献综述(Review)是指科研工作者针对某一科学问题,通过广泛阅读文献和归纳整理的基础上,对特定科学问题的历史背景、研究现状、争论焦点和发展前景等内容进行评论的科学性论文。一篇合格的文献综述应包括「综」和「述」两个方面。「综」就是指作者必须对占有的大量素材进行归纳整理、综合分析,而使材料更加精炼、更加明确、更加层次分明、更有逻辑性。「述」就是评述,是对所写专题的比较全面、深人、系统的论述。对于从事科研的学生来说,无论是在日常的科学研究工作,还是硕博毕业论文的撰写中,研究者都无可避免的需要撰写文献综述。而面对纷繁复杂的文献,如何撰写一篇优秀的综述往往让科研小白摸不着头脑。因此,本文拟从以下几个方面谈谈综述的写作步骤及注意事项。 一、综述的写作步骤综述的撰写是在作者对拟研究的科学问题有关的原始文献进行广泛阅读的基础上进行的。因此,坚持阅读该领域的学术文献,及时跟踪前沿动态是写好综述的前提。同时,综述并不是对原始研究进行的简单堆砌,只有选题恰当、文献检索和整理全面、结构组织严谨的综述才能够撰写出一篇合格的综述。撰写文献综述一般要经过「选定题目」、「搜集整理文献」、「拟定提纲」,「撰写文章」
小伙伴们大家好!很多小伙伴在写作,尤其是英语写作的时候,由于受到中文口语的惯性思维影响,往往分不清「主」、「谓」、「宾」,「定」、「状」、「补」。其实,大多数小伙伴在写作 SCI 的时候并不需要十分清楚何为宾语、定语、状语、补语,只需要粗略地理解到「主语即是重心,谓语表示执行动作」,其他统统可以归类为「修饰语」即可。然而,今天笔者不是来分享英语语法课,而是通过实际例句来分享如何在英语写作中准确的表达中文原意。 例句 1 原意表达:在入院时,52 名肺炎患者血清中的 IL-1 水平明显高于对照组。原句: 图片来源:自己做的修改: 图片来源:自己做的修改原因:「At admission」意思为「在入院时」,而「on the day of admission」意思为「在入院当天」,前者更符合原意表达。「IL-1 levels in the serum」血清中的白介素-1 应该是句子重心,应该重点突出。「those」可以替代「IL-1 levels」,「the control group」中的「the」此处表指定对象,不能轻易省略。 例句 2 原意表达:单单比较 VAS 评分和 ROM 与
时光匆匆,一年又一年,毕业的脚步近了,又到了毕业生们「不想写论文」的季节。其实大家重点关注的问题无外乎两个:如何写好和如何写快。那么读一读接下来的写作攻略,也许会对在论文写作阶段的你们有所帮助。写论文的第一步:你需要搞清楚一篇合格毕业论文的结构是什么。毕业论文的框架其实很简单,通常分为 5-6 个章节。当然每个学校的要求可能有些差异,但万变不离其宗。①论文题目;②中(英)文摘要;③目录;④正文(包括引言/绪论、文献综述、具体实验方法及结果的分析,总结和展望等);⑤参考文献等下面说一说各部分的写作: 一、摘要摘要是论文整体的一个精炼。我个人的习惯是从引言和结论中挑出主要目的和结论。从方法和结果部分挑出重点句和重要的结果。随后将找出的句子和要点依据引言、方法、结果、结论的顺序组织成一段。这样做的目的是使读者在不阅读全文的前提下,就可以获得主要信息。Tips:摘要一般不引用文献;有用到缩略语时,第一次一定要标明全称;尽量使用简单句,表达要求简单完整,避免使用口语;切忌直接用翻译软件完成英文摘要,即使使用软件辅助也一定记住要自己手动修改润色。图片来源:文献截图 二、目录虽然每个学科专业的标题和
Cover Letter 对于投过 SCI 期刊的同学来说肯定不会陌生,当投稿进行到上传原始文稿的步骤时,往往需要同时上传一篇简短且充分的 Cover Letter 作为敲门砖,用来打头阵。一篇好的 Cover Letter 往往会令编辑眼前一亮,留下深刻的第一印象。由于 Cover Letter 的书写不能过于繁杂,整体篇幅要控制在 200 ~ 300 词。因此,如何利用精简的篇幅用 Cover Letter 把全部内容表述清楚且出色,也是一门学问 ! 1. 称呼Cover Letter 称呼的格式一般比较固定,其主要目的是先对杂志的编辑进行礼貌问候,随即引出下文,因此在书写的时候,格式为:Dear Editor of 「期刊名称」: 2. 写信目的Cover Letter 第一段的主要目的是对自己投稿的题目进行说明,并表明投稿立场。介绍文章题目全名并表明希望在本杂志发表文章的意愿后,要进行声明:此论文正在该杂志进行提交审议中,并且其全部或部分内容尚未以任何语言在其他杂志发表或提交;还要声明:所有的共同作者都对本论文的完成做出了重大贡献,所有作者都同意手稿的内容。该段立意的目的是避免
今年本人博士应届毕业,能按时毕业而不是延毕,听着就让人松口气。然而,去年这个时候,我连一篇 SCI 都没有,而学校的毕业要求是要一篇 5 分+一作 SCI,听着就让人压力很大……可是,能怎么办呢?导师不闻不问,甚至还「安慰」说,没事,大不了延毕一年……但凡稍微认命一点,可能都不会有真正属于自己的 5 分+一作 SCI了。所以,该挣扎还得挣扎!我给自己找的出路正是生信 SCI,有希望发表 5 分以上 SCI,做起来时间也比较快。直接找到合适的方向,再结合一点有实验平台补充点验证实验,这样生信结合基础的 5 分 SCI,听说可行性非常高,于是马不停蹄地开始找资源学习。20 年 3 月下旬的时候才听说生信(遗憾了解地确实晚了点,但只要开始都不算晚吧),然后在 PubMed 找了大量已发表的高质量生信 SCI 文章进行深入研读,大概确定了自己的研究思路后,开始边学习边实战。以下是具体学习过程和经验,希望可以帮到大家 ~ 1. 谋其上得其中,明确自己的目标我的目标是发 5 分+ SCI ,所以参考的生信文献,至少 5 分。个人的选题方向也比较明确。我定是单基因的思路,综合考虑实验室可以验证的条件
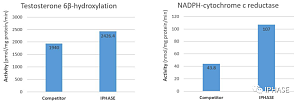
药物被机体吸收后,在体内各种酶以及体液环境作用下发生化学结构的改变的过程,称为药物代谢(Drug metabolism),又称生物转化(Biotransformation)。药物代谢主要在肝中进行,也发生在肠、肾、肺、血液和皮肤等器官,尤其是药物的肠代谢越来越受到人们的关注。口服药物主要经小肠和大肠吸收进入肠毛细血管床,它是药物进入体内的一条重要途径,但研究发现许多药物通过肠道时即被代谢,这种肠道的首过效应往往造成进 ...
「丁香实验」小程序上线后,已经汇集上万条实验 protocol、常见操作问答、科研方法文章等。 为了能给科研人带来更多的交流与互助,现开展一期「WB 实验大赛」。 晒出你的实验方法和结果图( beta-actin 或者其他内参均可)就有机会瓜分 1000 元现金奖! 你将会获得丰富奖金上至 500元/人、丰富的科研周边、建立个人专题打造个人 IP 、增加实验室曝光、论文引用机会! 我们希望你有着丰富的 WB 实验经验,实验优化小建议,并愿意分享自己的经验。 你需要完成1、入群参与活动,上传个人 WB 结果图与步骤2、分享个人实验页面,邀请同学、好友为你点赞! 活动参与方式扫描下方海报中的二维码,立即参赛!
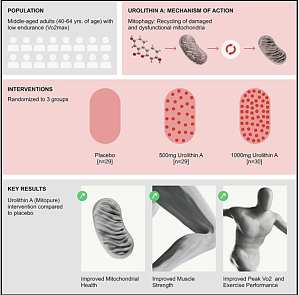
肌肉质量和力量随着年龄的增长而逐渐下降是不可抵抗的自然规律,但饮食和锻炼等环境因素则可影响其下降的速度和趋势。不过截至目前,还没有有效的干预措施来对抗与年龄相关的肌肉衰退。虽然说运动和营养膳食是预防和管理与年龄相关的肌肉健康下降和代谢性疾病的主要干预措施,但一定强度的锻炼需要长期的坚持,而这却很难维持。 尿石素 A(Urolithin A, UA)是源于膳食的菌群衍生代谢产物,可激活线粒体自噬,在动物模型中具有改善衰老动物的肌肉健康的作用。UA 是鞣花丹宁、多酚化合物的代谢产物,这种前体很容易获得,在自然界中几乎是无处不在的。常见的富含鞣花酸和鞣花单宁的食物包括石榴、树莓、蓝莓、核桃等。 UA 也已被证明在衰老和疾病的临床前模型中具有诱导损伤线粒体自噬功能。另外,从临床转化的角度来看,久坐的老年人口服 UA 4 周后,能显著增强骨骼肌中线粒体基因的表达,从而达到改善细胞健康的目标。 2022 年 5 月 17 日,来自瑞士的一个科研团队在 Cell Reports Medicine 发表了题为 Urolithin A improves muscle strength, exercise
磁性细胞分选(MACS)是一种20世纪70年代发展起来的相对高效简便的细胞分选方法,所需设备和操作较为简单,对操作人员的技术要求也不高,只是让细胞处于一个低磁场中,基本可以忽略对细胞的影响,分离得到的细胞具有较高的复苏率及细胞活性,对于下游应用影响较小,在保持细胞活性方面优于流式分选,是细胞分选的首选方法,具有潜在的应用前景。1 磁性细胞分选原理磁性细胞分选是基于免疫学中抗原抗体之间特异性结合的原理进行的。以磁性 ...
摄入的食物如何控制我们的大脑和行为一直是人们非常感兴趣的问题。过去的研究表明,蛋白质可以抑制食欲,因此很多减肥人群通过适当增加饮食中蛋白质的摄入比例来帮助减肥,这也是近年来高蛋白饮食方式越来越受欢迎的原因之一。 蛋白质在肠道中被分解成氨基酸,根据人体是否可以通过自身合成或从其他氨基酸转化而来,可将氨基酸分为必需氨基酸与非必需氨基酸两类。尽管人们已经知道,必需氨基酸和非必需氨基酸都可以抑制食欲,但对于非必需氨基酸,其在生物体内的作用方式尚未得到证实。 近日,苏黎世联邦理工学院的研究人员首次在生物体中证明,非必需氨基酸(non-essential amino acids, NAAs)以抑制食欲和促进运动的方式影响大脑,研究成果以 Ingested non-essential amino acids recruit brain orexin cells to suppress eating in mice 为题发表在 Current Biology 上,他们的研究揭示了控制这种行为背后的神经机制。 研究成果(图源:Current Biology) 为了实现对摄入时间和摄入内容物的精确控制,研
一、实验概要PCR 扩增目标 DNA 片段。 二、实验原理多聚酶链式反应(polymerase chain reaction, PCR)基本原理类似于 DNA 的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。PCR 由变性、退火、延伸三个基本反应步骤构成。1. 模板 DNA 的变性:模板 DNA 经加热至 93℃ 左右一定时间后,使模板 DNA 双链或经 PCR 扩增形成的双链 DNA 解离,使之成为单链,以便它与引物结合,为下轮反应作准备;2. 模板 DNA 与引物的退火(复性):模板 DNA 经加热变性成单链后,温度降至55℃ 左右,引物与模板 DNA 单链的互补序列配对结合;3. 引物的延伸:DNA 模板-引物结合物在 Taq DNA 聚合酶的作用下,以 dNTP 为反应原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条新的与模板DNA 链互补的半保留复制链重复循环变性、退火、延伸三过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。每完成一个循环需 2~4分钟, 2~3 小时就能将待扩增的目的基因扩增放大几百万倍。 典型的 PCR 反应
NK细胞是人体免疫的第一道防线,具有非限制性杀伤的特点,如何发挥NK细胞的免疫作用从而治疗肿瘤等疾病是一个重要的课题。因为NK细胞仅占外周血的5-10%,细胞数量的稀少往往是制约研究的一个重要原因。本产品用于从单个核细胞(MNC)在体外高效扩增成NK细胞,具有扩增效率高,目的细胞百分比高的特点,起始单个核细胞经过14天培养,总细胞数可以扩增约50倍左右,NK细胞数可以扩增500倍以上,且纯度可达70%-85%(由于 ...
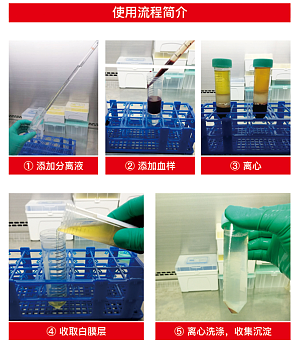
【实验操作步骤】1 使用移液管(枪)吸取15ml淋巴细胞分离液注到50ml分离管下室(15ml分离管吸取4ml);注意:请用移液管直接将淋巴细胞分离液通过隔板小孔注到分离管下室,勿将分离液置于分离管上室,否则分离液难以流至下室,影响后续分离操作。2在50ml分离管中加入2-30ml稀释血液样品(15ml分离管倒入0.5-8ml);注意:1)请勿将稀释血液样品注入到隔板下室;2)请将稀释血液从隔板上方缓缓加入,所加入的位置勿 ...
正常人外周血中的干/祖细胞的含量占有核细胞数的1%左右,经有效动员后,骨髓中的造血干细胞会释放到外周血中,使外周血中的干/祖细胞比例明显增高。动员外周血是指用有效的动员剂对供者进行动员后采集的外周血。重组人粒细胞集落刺激因子(rhG-CSF)是外周血动员最常用的动员剂,它可选择性的作用于粒系造血祖细胞,促进其增殖、分化,并可增加外周血中性粒细胞的数目和功能。动员外周血单个核细胞是采集经动员后的健康供者的外周血,采 ...
骨髓单个核细胞(Bone Marrow Mononuclear Cells,BMMNCs)是一群混合细胞,其中绝大多数是早幼粒细胞、早幼红细胞、成熟B细胞、T细胞和单核细胞等,还含有少量的干细胞,包括间充质干细胞、造血干细胞和内皮祖细胞等,它们密度相近,因此可通过密度梯度离心法从骨髓液中分离出来。1 原理单个核细胞的体积、形态和比重与其它细胞不同,在沉降过程中不同比重的细胞会处于不同的分布位置。因此,可利用各种血细胞和单个核细胞 ...
脐带血是指胎儿出生时脐带内及胎盘近胎儿一侧血管内的血液。脐带血单个核细胞(Cord Blood Mononuclear Cell,CBMC) 分离自正常人胎盘脐带组织,是脐带血中具有单个核的细胞,包括淋巴细胞和单核细胞等,是机体防御系统的一个重要组成部分。1 原理单个核细胞的体积、形态和比重与其它细胞不同,在沉降过程中不同比重的细胞会处于不同的分布位置。因此,可利用各种血细胞和单个核细胞比重之间的差异将各种血细胞与单个核细胞分离 ...
脾脏(spleen)位于上腹部左后侧,体积较大,长条形,是体内最大的淋巴器官,也是血流通路中的过滤器官。脾脏内定居着大量的淋巴细胞和其它免疫细胞,是机体发生特异性免疫应答的场所。1 原理单个核细胞的体积、形态和比重与其它细胞不同,在沉降过程中不同比重的细胞会处于不同的分布位置。因此,可利用各种血细胞和单个核细胞比重之间的差异将各种血细胞与单个核细胞分离开来。2 方法1)无菌条件下取出脾脏,在培养皿中加入适量的分离液,将脾 ...