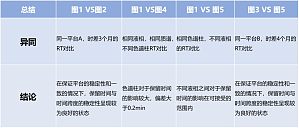
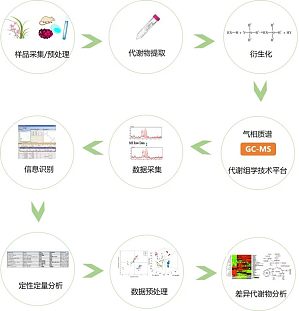
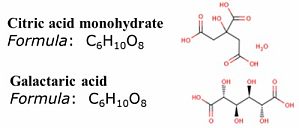
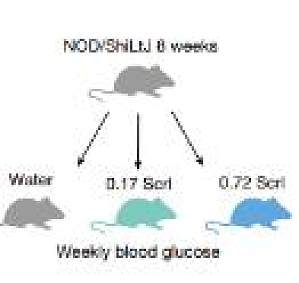
1.代谢组学数据存在的弊端代谢组学相较于系统生物学的其他组学来说,拥有海量的数据(尤其是非靶向代谢组学数据),通常来说,代谢组学数据的特点有:a.高噪声:生物体内含有大量维持机体生理作用和功能的内源性小分子,具有特定研究意义的生物标志物以及功能代谢物只是其中很少的一部分。绝大部分的代谢物和研究目的无关,这就造成了在整体代谢物背景下,少部分的功能代谢物受到绝大部分无用代谢物的噪声干扰会相对严重;b.高维度(相对小样本):通常来说,非靶向代谢组检测到的代谢物的数量远大于样本个数,因此处理代谢组的数据不能选择使用传统的统计学方法;c.鉴定难度大:多方面的因素导致代谢组的数据的鉴定和定性难度较大,比如同分异构体、理化性质相近的代谢物、液相体系、代谢物质谱结构解析的困难等等。d.高度不规则:代谢组数据分布很不规则,有可能数据中会出现很多 0 值,这需要采用更加复杂合理的统计分析策略来揭示隐藏其中的复杂数据关系。一份数据,要承受多少次的鉴定筛选,才能熬过 reviewer 的火眼;你是否曾经历过 reviewer 对于数据鉴定的质疑,比如:1.It seems there are many wro
GC-MS 非靶向代谢组学检测通过气质联用(GC-MS)方法检测生物体受外界刺激前后体内大多数小分子代谢物的动态变化,重点寻找在实验组和对照组中有显著变化的代谢物,进而研究这些小分子代谢物变化,实现对生命科学中更多问题的探索。1.GC-MS(气质联用)相关介绍GC-MS 分离检测的原理:利用待分离的各种物质在两相中的分配系数、吸附能力等理化性质的不同来进行分离,然后进入质谱检测器进行检测的过程。GC-MS 仪器分为三个系统:进样系统、分离系统、检测系统。GC-MS 的适用范围:主要取决于化合物的性能,一般适用于分子量小、易挥发的代谢物2.GC-MS 优势及流程运用GC-MS代谢组学探究优势:1)技术成熟稳定、分辨率高、选择性好;2)具有相对完善的数据库;3)适合于复杂基质的分析,一次分析提供全面的信息;4)全自动峰识别、解卷积、样品比较、质量控制;5)定性更准(结合保留时间指数辅助定性);3.GC-MS 代谢工作流瓶颈除了代谢物的提取,代谢物的纯化与富集也是非常重要的;那么纯化和富集的目的是什么呢?纯化主要是为了去除蛋白质、核酸、盐或者干扰目标代谢物检测的其他代谢物;富集的目的主要是提
近年来科学家们对代谢组学的关注度越来越高,有大量的代谢组学 SCI 得以发表,它成为继基因组学、转录组学和蛋白质组学之后的又一个热点研究领域。2019~2022 年代谢组学 SCI 发表数量在 PubMed 中检索“Metabolomics OR Metabolome”,2019~2022 年 8 月为止,共发表相关论文 36,135 篇。以今年当前发文量(7324 篇)来看,已逼近 2019 的全年发文量,可见它在当下科研界的火热程度。看到代谢组学研究越来越受到重视,可是真正当你着手去做代谢组学的时候才能体会什么是无助!三大组学,哪个分析难度最高、水最深?小编认为非代谢组学莫属。为什么?基因/转录组=测核苷酸排列,4 种核苷酸组成;蛋白组=测氨基酸排列,20 种氨基酸组成;代谢组=测核苷酸+氨基酸+糖+有机酸+脂类等组成,每一类都有 N 种。分析化学没学好?色谱玩不溜?原始图谱不会看?算法不太懂?如果是这种情况,可能连代谢组学的门都难摸到。代谢组学做得好的平台,基本都是有 N 年分析化学经验的大牛。对于生物领域研究的老师,也许我们并不需要过分关注检测分析实验的细节。但是,对于代谢组分
导读人工甜味剂在许多食品中被用作无卡路里的糖替代品,其消费量在过去几年中大幅增加。不久前,一篇发表在Nature Medicine杂志上的文章就揭示了常见人工甜味剂赤藓糖醇的危害。研究人员通过对美国和欧洲的 4000 多人进行研究,他们发现血液中赤藓糖醇水平较高的人发生心脏病、中风或死亡等重大心脏不良事件的风险更高。除赤藓糖醇外,三氯蔗糖也是一种常用的无卡路里甜味剂,比蔗糖甜约 600 倍,常用于饮料和食物中。最近的一些研究表明,三氯蔗糖可以通过影响微生物组来影响人类健康,但人们还不完全了解三氯蔗糖对身体的影响,也对食用某些甜味剂的长期安全性提出了担忧。2023 年 3 月 15 日,来自英国弗朗西斯克里克研究所等单位的研究团队在Nature发表了题为The dietary sweetener sucralose is a negative modulator of T cell-mediated responses的文章,在本研究中,他们发现,小鼠摄入高剂量的三氯蔗糖可通过限制 T 细胞增殖和 T 细胞分化而产生免疫调节的作用。在皮下肿瘤模型和细菌感染模型中,给予三氯蔗糖的小鼠的 C
「阿嚏!」又是一年花粉季,很多小伙伴可能面临花粉过敏的困扰。服用抗过敏药之后,过敏症状得到缓解,却会感到昏昏欲睡。这是为什么呢?原来抗过敏药物中含有抗组胺成分。当抗组胺药通过血脑屏障进入大脑,阻断中枢组胺受体,就会引起嗜睡。组胺(histamine,HA)作为体内一种重要的信号分子,广泛参与免疫、消化和神经信号调控。抗组胺药物常被用来缓解过敏,但其导致嗜睡的副作用引起科学家开始关注组胺在中枢神经系统中的功能。目前已知,组胺在中枢神经系统是调控睡眠觉醒的重要分子,其信号还参与学习记忆和摄食等重要行为,但其分子调控机制仍是未解之谜。为此,人们亟需发展灵敏、特异的工具用于高时空分辨率监测组胺动态变化。2023 年 3 月 15 日,北京大学李毓龙实验室在Neuron杂志在线发表研究论文,报道了一种新型基因编码的组胺探针 GRABHA的开发,并结合这一新工具深入探究了睡眠觉醒过程中组胺的动态调控。李毓龙实验室长期致力于系统性发展神经化学分子检测技术,先后开发了针对乙酰胆碱、多巴胺、去甲肾上腺素、五羟色胺、嘌呤类、脂类和多肽类神经递质/调质的荧光探针,此次发表的 GRABHA 进一步拓展了 GR
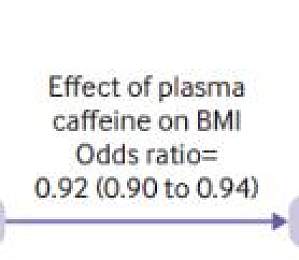
咖啡因是世界上消耗最广泛的精神活性物质,主要来源是咖啡和茶。先前已有多项研究证明了喝咖啡和茶的健康益处,例如,每天喝 3~5 杯咖啡(一杯普通咖啡中含有约 70~150 毫克咖啡因),与降低患 2 型糖尿病和心血管疾病的风险有关。但是迄今为止,大多数已发表的研究只涉及观察性研究,无法可靠地确定咖啡因与疾病发生的因果效应。2023 年 3 月 14 日,一项题为Appraisal of the causal effect of plasma caffeine on adiposity, type 2 diabetes, and cardiovascular disease: two sample mendelian randomisation study的研究发表在BMJMedicine上,该研究指出血浆中较高的咖啡因浓度可能会降低肥胖和患 2 型糖尿病的风险,且咖啡因对 2 型糖尿病易感性的影响大约有一半(43%)是通过身体质量指数(BMI)降低来实现的,未来或可为指导临床减轻代谢疾病负担提供理论依据。图 1 相关发文(图源:[1])一、数据收集和分析咖啡和茶是咖啡因摄取的主要来源,除
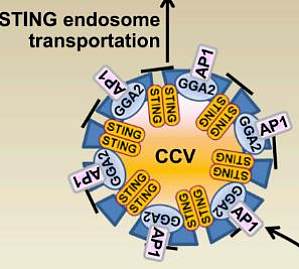
cGAS-STING 通路是负责识别胞质 DNA 免疫应答的主要通路1。cGAS 作为胞质 DNA 受体,可以被 DNA 和/或 Mn2+激活并利用 ATP 和 GTP 合成第二信使 2'3'-cGAMP,后者进一步激活 STING 并诱导 I 型干扰素等细胞因子的产生,从而介导抗病毒/肿瘤免疫反应。研究表明多种病原微生物入侵及各种压力胁迫,如氧化应激、代谢紊乱及 DNA 损伤等都可导致胞质 DNA 的累积及 Mn2+ 浓度的升高,从而激活 cGAS-STING 通路。因此,cGAS-STING 信号通路在抵抗病原微生物感染、肿瘤及多种免疫相关疾病的发生及治疗中都发挥关键作用。磷脂酰肌醇磷酸(phosphoinositides,PIPs)是构成真核生物细胞膜组分的重要磷脂(占总磷脂的 5-10%),也是重要的信号分子2。由于肌醇六元环上 D-3,D-4 或 D-5 位都可发生磷酸化修饰,因此真核生物中总共存在 7 种不同 PIP 分子。PI4P(phosphatydyinositol 4-phosphate)是胞内含量最高的 PIP 分子,广泛分布于各种膜组分,且在反式高尔基体(tra
导读疫苗的发明,可谓是人类发展史上一件具有里程碑意义的事件。从牛痘疫苗、狂犬病疫苗到新冠疫苗,研发、生产并接种疫苗,在控制甚至是消灭传染性疾病中发挥了不可磨灭的作用。疫苗的保护作用取决于个体免疫反应的程度。在接种疫苗前,我们往往会被告知要保持充足的睡眠。但在过去的研究中,关于睡眠时间不足在流感和肝炎疫苗接种反应的个体差异中所起的作用也得到了一些不同的结果。当 COVID-19 大流行来袭,大规模疫苗接种成为了全球公共卫生安全的主要策略,是否能够通过简单的干预措施增加延长疫苗的保护效果这一问题也亟待解决。2023 年 3 月 14 日,来自里昂第一大学的研究团队在Current Biology杂志发表了题为A meta-analysis of the associations between insufficient sleep duration and antibody response to vaccination文章,通过荟萃分析,研究人员探索了睡眠时间对接种疫苗免疫效果的影响。研究人员发现,在接种疫苗前后的日子里,每晚睡眠不足 6 小时与抗体应答的大幅下降相关,即机体降低了对疫苗
上个世纪 70 年代初,一种乳白色的药物被发现具有稳定、舒适的镇静作用,即丙泊酚,被麻醉医生形象的称为「牛奶」。丙泊酚自 1986 年正式进入临床使用以来,既可用于全身麻醉,也适用于手术时间短的小操作或检查,是静脉麻醉药中当之无愧的「王者」,每年服务全球亿万患者。其发明者约翰·格伦为此获得了有诺贝尔奖风向标之称的「美国拉斯克奖」临床医学类奖项。令人惊奇的是,丙泊酚的临床使用不仅带来了催眠、镇静与遗忘,还常常让入睡的患者产生美梦,使得他们心情愉悦,产生放松感。2023 年 3 月 13 日,上海科技大学生命科学与技术学院、国家精神疾病医学中心(上海市精神卫生中心)脑健康研究院、上海市第六人民医院麻醉科共同合作在Neuron上发表题为Propofol exerts anti-anhedonia effects via inhibiting dopamine transporter的研究论文,探索了丙泊酚产生欣快感的神经机制,并挖掘了「麻醉牛奶」这款「老药」在抑郁治疗中的新用途。研究者系统的筛查了丙泊酚对大脑内不同神经递质系统的影响,综合运用结构药理学、细胞生物学等手段,首次发现了丙泊酚能够
三月的倒春寒来势汹汹,科研人在奋斗征程中也要注意个人身体健康。本周学术君继续带来 CNS 最新进展,助力大家勇攀科研高峰!1.Nature Metabolism:锌促进雄性小鼠的交感神经支配目前,产热脂肪细胞对交感神经支配的调节尚不清楚。2023 年 3 月 6 日,同济大学栾冰团队在Nature Metabolism杂志发表研究论文Thermogenic adipocyte-derived zinc promotes sympathetic innervation in male mice。该研究表明产热脂肪细胞来源的锌促进雄性小鼠的交感神经支配,确定锌离子(Zn)作为一种产热脂肪细胞分泌因子,促进雄性小鼠棕色脂肪组织和皮下白色脂肪组织的交感神经支配和产热,解析了产热脂肪细胞和交感神经元相互调节的正反馈机制。图 1:来源Nature Metabolism2.STTT:揭示结直肠癌来源的细胞外囊泡的重要作用细胞外囊泡可谓小小的身体,大大的能量,在医学健康领域扮演着重要的角色。2023 年 3 月 6 日,四川大学王自强及韩俊宏共同通讯在Signal Transduction and T
目前,肥胖和超重是许多慢性疾病的主要危险因素。根据世卫组织最新数据显示,全球已有超 10 亿人患有肥胖症,其中包括 6.5 亿成年人、3.4 亿青少年和 3900 万儿童,减肥大业迫在眉睫。在此背景下,「间歇性禁食」(Intermittent Fasting)已发展成为一种备受大众欢迎的减肥方法。间歇性禁食也称有时间限制的进食,通常指在某个时间段内正常进食食物,然后很长一段时间(16-48 小时)内吃很少的食物或者不吃。多项研究表明,间歇性禁食通过控制食物摄入时间可调节代谢功能,从而实现体重的减轻。此外,随机临床试验也揭示,与全天进食相比,限制进食不仅可减轻体重,还有减少腹部脂肪,调节葡萄糖和胰岛素、平衡血压血脂等优势。然而,最新发布在《美国心脏协会杂志》(JAHA)的一项研究表明,就管理体重而言,控制热量的总摄入可能比将进餐限制在狭窄的时间窗口更为有效。2023 年 2 月 7 日,美国约翰霍普金斯大学医学院在JAHA上发表题为Association of Eating and Sleeping Intervals With Weight Change Over Time: The
在哺乳动物中,新生命开始于精子与卵细胞成功相遇,形成受精卵,然后子代携带来自双亲的部分遗传物质。长久以来,这都是自然界中哺乳动物繁衍后代的定律,也是维持种群的重要方式。在鱼类和爬行动物中,还存在一种普遍的繁殖方式,称为孤雌生殖,仅由从未受精的卵母细胞产生后代,但这在哺乳动物的自然繁殖中并未发现。孤雄生殖这一方式更是罕见,仅在一种稀有杂交鱼类和一些无脊椎动物中有发现。2023 年 3 月 8 日,在弗朗西斯·克里克研究所举行的第三届国际人类基因组编辑峰会上,来自日本九州大学的Katsuhiko Hayashi介绍了他们的最新研究:通过将雄性小鼠细胞转化为卵子,他们最终创造了具有两个亲生父亲的小鼠后代。Katsuhiko Hayashi(图片来源:网络)研究人员将携带男性 XY 染色体的皮肤细胞重新编程为干细胞样状态,即所谓的诱导多能干细胞(iPSCs)。然后删除这些细胞中的 Y 染色体,并替换为从另一个细胞「借用」的 X 染色体,以产生具有两条相同 X 染色体的诱导多能干细胞。随后,将该细胞放置在卵巢类器官(一种复制小鼠卵巢内条件的培养系统)中培养,使其变成卵子。并将该卵子与正常精子结合
基因编辑技术在植物中的开发和应用为分子设计育种带来了革命性的变化。基于基因编辑技术建立基因精细调控的方法对于精准设计育种至关重要。目前应用最为广泛的基因表达调控方法,如 CRISPR-Cas、CRISPRi 和 RNAi 等技术只能够实现对基因的完全敲除或将基因的表达抑制到不可预测的水平。利用 CRISPR-Cas9 技术对启动子区域进行编辑,可以在转录层面将基因的表达调控至不同的水平,并产生大量不可预测的数量性状变异。但这种方法将耗费大量精力用以筛选理想的突变体。因此,开发新的能够可预测地精细调控基因表达的方法可以极大拓展现有的基因表达调控工具箱,为作物遗传改良提供有力的技术支撑。上游开放阅读框(uORF)是真核生物 mRNA 上普遍存在的翻译调控元件,对基因主效开放阅读框 (primary open reading frame, pORF) 的翻译具有抑制作用。2018 年,中国科学院遗传与发育生物学研究所高彩霞研究组率先利用 CRISPR-Cas9 技术对 uORF 进行编辑,建立了精细上调内源基因翻译的方法,并利用该方法培育出了维生素 C 含量显著提高的生菜种质。2020 年,
质谱成像(MSI)具有同时显示组织中已知或未知生物分子相对丰度和空间分布的能力,已广泛用于癌症和其他疾病的组织学诊断。然而,由于组织样品的复杂性和异质性,全面绘制代谢物的分布图仍然具有挑战。尤其是对于那些具有广泛生物功能但丰度较低的代谢物,需要开发一种无针对性的,高灵敏度,覆盖范围广,化学特异度高的成像方法,以可视化多种代谢物在原始状态下的空间分布。本课题组对自主研发的气流辅助解吸电喷雾电离质谱成像(AFADESI-MSI)进行了优化,通过非靶向分析,在大鼠脑、肾脏和人食道癌组织中观察到数千种代谢物,为分子组织学研究提供了有力的分析工具。中国医学科学院药物研究所再帕尔·阿不力孜教授、贺玖明研究员课题组在 Advanced Science发表的题为“A Sensitive and Wide Coverage Ambient Mass Spectrometry Imaging Method for Functional Metabolites Based Molecular Histology”的研究论文,通过优化的空气动力辅助解吸电喷雾质谱成像(AFADESI-MSI)技术,绘制了生物样
绝对定量时代——引领慢病毒行业新标准高大上的慢病毒是怎样炼成的(一)慢病毒活性滴度用什么单位?看TU!看 TU!看 TU!TU=transducing units,即每毫升中含有的具有生物活性的病毒颗粒数。其他的VG/mL,VP/mL 都是所有病毒颗粒数,死的活的都算上,一片虚假繁荣,请自由玩儿去!慢病毒活性滴度怎么标定最准?绝对定量!绝对定量!绝对定量!又绝对又定量的方法,准到不要不要的!再说了,这「绝对定量」是医疗级病毒产品的公认滴度检测方法,诺华、Juno,这些 CarT 大佬们都用!不准?不准的话 FDA 能认吗?复杂又昂贵的方法,为了准,咱们忍啦!标准品检定绘制标准曲线,精确定量病毒基因组DNA 拷贝数。测定插入细胞基因组的 5'LTR—3'LTR 病毒基因组拷贝数。工具细胞 293T 基因组中的病毒特征单拷贝基因 A 和宿主特征单拷贝基因 B。TU=undefinedC/V=(初始细胞/感染病毒体积)×(2×A 基因拷贝/B 基因拷贝),计算感染效率。不要反转录,不要受 RNA 降解或反转录效率影响。如果病毒有荧光或者抗性,再结合表型联合判断。慢病毒滴度标那么准,有用吗?为啥细胞用慢病毒
转染是否成功的影响因素很多,如需要转染的细胞类型(对于困难的细胞系尤其如此),需要被转染的分子(DNA、RNA、寡核苷酸、蛋白质),转染试剂等。但无论在何种情况下,转染的成功均取决于转染效率、低细胞毒性以及重现性这几个要素。细胞分裂细胞相比较非分裂细胞——分裂细胞往往要比静止细胞更易于摄取并表达外源 DNA。因此对大多数转染操作而言,细胞都在转染当天或前一天种板。同样重要的是细胞在种板进行转染时不应处于过度生长的状态;此外,还常用促有丝分裂刺激物(如,病毒转化,生长因子,条件培养基,以及滋养细胞)来活化原代培养细胞。贴壁细胞相比较悬浮细胞——在转染效率方面贴壁细胞和悬浮细胞之间的差异显著。相对于贴壁细胞(如 HEK,CHO),悬浮细胞(如 HL 60,Jurkat)非常难以转染,可能是因为细胞间膜结构的差异,但目前还没有分子水平上合理机制的解释。分板方案——在对培养细胞进行分板传代培养之前,必须把贴壁细胞用胰蛋白酶消化使之脱离培养基质。这个常规操作可导致正常细胞功能受到严重损害。因此分批方案的不同(如,胰蛋白酶消化时间的长短,胰蛋白酶的灭活等)需要优化。传代次数——传代次数是指对一个细