ChemBioChem - 微量热泳动仪MST测量多肽和亚基结合
Quantum量子科学仪器
南开大学南开大学元素有机化学国家重点实验室使用最新的分子间相互作用分析仪-微量热泳动仪MST -NT.115测量多肽和不同来源的AHASs的催化亚基CSU的亲和力并比较其差异,获得良好的数据并发表到最新一期的ChemBioChem杂志上。
之前,该课题组尝试其他方法(包括ITC方法)测定没有得到结果,因为其样品稳定性很差无法固定并且相互作用热量变化极小。
正乙酰羟基酸合成酶(AHASs)是催化支链氨基酸的生物合成的第一个酶,由一个催化亚单位(CSU)和调节亚基(RSU)组成。CSU稳定催化部位,RSU是负责激活和CSU的反馈调节。之前的结果表明,大肠杆菌AHAS的同功酶可以实现异源物的激活。
因此找到ilvH(RSU大肠杆菌AHAS III)中的最基本的肽段就可以激活其他大肠杆菌,甚至那些其他物种的CSUs,这将是很有意义的发现。在本文中,我们构建了ilvH的C-端,N-端,和C-端和N-端截断突变体。能激活ilvI(CSU的大肠杆菌AHAS III)的最基本多肽序列被确认是N14-C89。
此外,这种肽不只能激活其同源ilvI和异源的ilvB(大肠杆菌AHAS I中的CSU),而且也能激活的酿酒酵母、拟南芥、和白花丹叶烟草中AHAS来源的CSUs 催化单元。 但是这种肽完全失去了由缬氨酸调节的反馈调节能力,从而显示不同的激活和反馈调节机制。
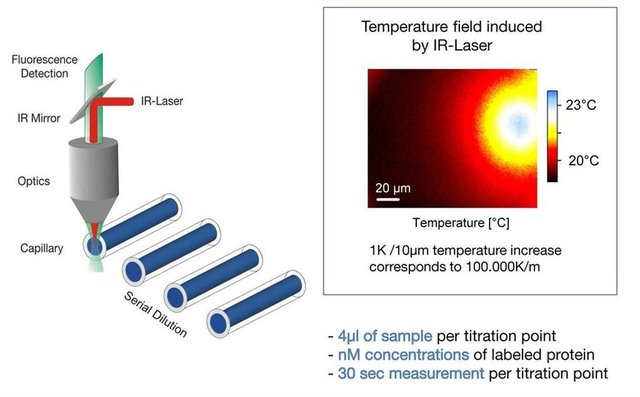
通过Nanotemper公司的微量热泳动仪MST测量出来的结合催化N14-C89与不同来源的CSUs的解离常数(Kd)的范围为9.3 - -66.5 uM。这种肽激活不同的CSUs的能力与他们结合CSUs的能力明显不吻合,从而表明关键残基的催化功能比结合能力要重要很多。
高序列相似性的肽DN14-DC89来RSUs跨越物种暗示这种肽代表RSU中的最小的激活基序,并能调节所有来源的 AHASs。
“我们目前致力于除草剂抗性的分子机制以及寻找新的除草剂靶点(比如AHAS亚基间相互作用的界面)等方面的研究。通过MST,我们测量了蛋白质-蛋白质相互作用,而我们的样品使用ITC方法测定没有得到结果,因为我们的样品稳定性较差并且相互作用热量变化极小。
所以在这些研究领域,MST技术能够很好地与传统的技术互补。
我们非常推荐MST技术的一些特点,如低样品使用量、很短的测量时间以及在分子间相互作用方面很广泛的应用。”
——席真教授(南开大学化学学院副院长)给予MST技术很高的评价
文章来自ChemBioChem