蛋白分离纯化
大肠杆菌表达蛋白以可溶和不溶两种形式存在,需要不同的纯化策略。现在,许多蛋白质正在被发现而事先并不知道它们的功能,这些自然需要将蛋白质分离出来后,进行进一步的研究来获得。
大约 30% 基因编码 MPs,膜蛋白占到新药物~50%的靶点。但MP’s 很难被成功表达,在成功解析出结构的蛋白中,只有<1%是膜蛋白。
蛋白质在细菌中表现后,以反复的冷冻-解冻方法打破细胞,再用硫酸铵把蛋白质沉淀下来,此步骤可以去除大部份核酸、多醣、脂质等杂物。
不同大小的蛋白质分子进入胶体过滤管柱,可依其分子量差异分离;是一种广泛应用的partition色析法 (Pharmacia操作手册, Gel Filtration)。
各种蛋白质分子上可能带有不同的电性,经过离子交换管柱,可依其分子带电性的差异而分离开来 (Pharmacia 操作手册,Ion Exchange)。
若表达蛋白质上含有一段六个His 的片段,而亲和吸附胶上接有镍离子,此蛋白质会特异性地结合到吸着胶体;洗去杂质后可imidazole 洗脱目标蛋白质。
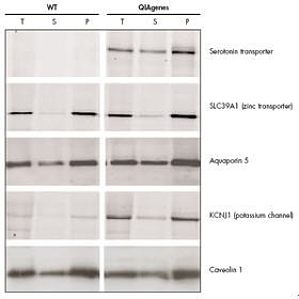
众所周知,膜蛋白在细胞间接触、表面识别、信号转导、酶活性和运输方面都扮演着重要的角色。由于它们功能多样,也就成为理想的药物靶点。然而,膜蛋白的生化和结构研究一直都很缓慢。Protein Database的统计数据表明,在成功解析出三维结构的蛋白中,膜蛋白只占1%,这与膜蛋白占总蛋白的1/3的总量的差别巨大。由此也可以看出膜蛋白研究确实困难重重。
动物细胞或组织的蛋白质的抽提步骤
微管蛋白的可溶性表达及纯化
亲和层析的应用主要是生物大分子的分离、纯化。下面简单介绍一些亲和层析技术用于纯化各种生物大分子的情况。 1.抗原和抗体 利用抗原、抗体之间高特异的亲和力而进行分离的方法又称为免疫亲和层析。例如将抗原结合于亲和层析基质上就可以从血清中分离其对应的抗体。在蛋白质工程菌发酵液中所需蛋白质的浓度通常较低用离子交换、凝胶过滤等方法都难于进行分离而亲和层析则是一种非常有效的方法。将所需蛋白质作为抗原经动物免疫 ...
1.上样 亲和层析纯化生物大分子通常采用柱层析的方法。亲和层析柱一般很短,通常10cm左右。上样时应注意选择适当的条件,包括上样流速、缓冲液种类、pH、离子强度、温度等,以使待分离的物质能够充分结合在亲和吸附剂上。 一般生物大分子和配体之间达到平衡的速度很慢,所以样品液的浓度不易过高,上样时流速应比较慢,以保证样品和亲和吸附剂有充分的接触时间进行吸附。特别是当配体和待分离的生物大分子的亲和力比较小 ...
亲和层析的实验操作和一般柱层析类似,都包括:装柱、上样、洗脱、样品收集、结果处理等步骤。 溴化氰活化琼脂糖用于配体固相化是实验室亲和层析最常用的技术之一,该方法简便廉价,并广泛应用于蛋白质、核酸、凝集素等。下面以此为例介绍亲和层析的实验方法: 试剂与配制 1.Sepharose 4B 2.CNBr(剧毒) 3.抗原或抗体 4.1Mol/L NaHCO3 取NaHCO3 84.01g加水至1 00 ...
选择并制备合适的亲和吸附剂是亲和层析的关键步骤之一。它包括基质和配体的选择、基质的活化、配体与基质的偶联等等。 基质 基质的性质 基质构成固定相的骨架,亲和层析的基质应该具有以下一些性质: 1.具有较好的物理化学稳定性。在与配体偶联、层析过程中配体与待分离物结合、以及洗脱时的pH、离子强度等条件下,基质的性质都没有明显的改变。 2.能够和配体稳定的结合。亲和层析的基质应具有较多的化学活性基团,通过 ...
生物分子间存在很多特异性的相互作用,它们之间都能够专一而可逆的结合,这种结合力就称为亲和力。亲和层析就是通过将具有亲和力的两个分子中一个固定在不溶性基质上,利用分子间亲和力的特异性和可逆性,对另一个分子进行分离纯化。 被固定在基质上的分子称为配体,配体和基质是共价结合的,构成亲和层析的固定相,称为亲和吸附剂。 亲和层析时首先选择与待分离的生物大分子有亲和力物质作为配体,并将配体共价结合在适当的不溶 ...
1.生物大分子的纯化 凝胶过滤是依据分子量的不同来进行分离的,由于它的这一分离特性,以及它具有简单、方便、不改变样品生物学活性等优点,使得凝胶过滤成为分离纯化生物大分子的一种重要手段,尤其是对于一些大小不同,但理化性质相似的分子,用其它方法较难分开,而凝胶过滤无疑是一种合适的方法。例如对于不同聚合程度的多聚体的分离等。 2.分子量测定 外水体积是指凝胶柱中凝胶颗粒周围空间的体积,也就是凝胶颗粒间液 ...
1.层析柱的选择 层析柱大小主要是根据样品量的多少以及对分辨率的要求来进行选择。一般来讲,主要是层析柱的长度对分辨率影响较大,长的层析柱分辨率要比短的高;但层析柱长度不能过长,否则会引起柱子不均一、流速过慢等实验上的一些困难。一般柱长度不超过100cm,为得到高分辨率,可以将柱子串联使用。层析柱的直径和长度比一般在1:25-1:100之间。用于分组分离的凝胶柱,如脱盐柱由于对分辨率要求较低,所以一 ...
凝胶过滤实验方法 1.凝胶的选择 根据层析物质分子量的大小选择不同型号的凝胶,如除盐和除游离的荧光素,则可选用粗、中粒度的G25或G50,G250多用于分离蛋白质单体,G200多用于分离蛋白质凝胶聚合体等。 2.凝胶的预处理 称取适量的凝胶加入过量的缓冲液在冰箱(或室温)中充分膨胀,或在沸水中煮,膨胀时间应根据不同型号的凝胶而定。 凝胶量与型号和层析柱大小与规格及凝胶用量 ...
1.凝胶层析操作简便,所需设备简单。有时只要有一根层析柱便可进行工作。分离介质—凝胶完全不需要像离子交换剂那样复杂的再生过程便可重复使用。 2.分离效果较好,重复性高。最突出的是样品回收率高,接近100%。 3.分离条件缓和。凝胶骨架亲水,分离过程又不涉及化学键的变化,所以对分离物的活性没有不良影响。 4.应用广泛。适用于各种生化物质,如肽类、激素、蛋白质、多糖、核酸的分离纯化、脱盐、 ...
凝胶是一种多孔性的不带表面电荷的物质,当带有多种成分的样品溶液在凝胶内运动时,由于它们的分子量不同而表现出速度的快慢,在缓冲液洗脱时,分子量大的物质不能进入凝胶孔内,而在凝胶间几乎是垂直的向下运动,而分子量小的物质则进入凝胶孔内进行“绕道”运行,这样就可以按分子量的大小,先后流出凝胶柱,达到分离的目的。 具有分子筛作用的物质很多,如浮石、琼脂、琼脂糖、聚乙烯醇、聚丙烯酰胺、 ...
1,透析袋浓缩法 利用透析袋浓缩蛋白质溶液是应用最广的一种。将要浓缩的蛋白溶液放入透析袋(无透析袋可用玻璃纸代替),结扎,把高分子(6000-12000)聚合物如聚乙二醇(碳蜡)、聚乙烯吡咯、烷酮等或蔗糖撒在透析袋外即可。也可将吸水剂配成30%-40%浓度的溶液,将装有蛋白液的透析袋放入即可。吸水剂用过后,可放入温箱中烘干或自然干燥后,仍可再用。 主要用于更换蛋白质的缓冲液,有透析袋即可,不需要特 ...