合作专家 | 孙汉寅硕士
生物与医药学 中国科学院大学
审核专家 | 聂壹峰博士
纳米生物医学 中国科学院大学
简介
作为高度分化的多核巨细胞,破骨细胞主要来源于单核/巨噬细胞造血干细胞系,是一种具有骨吸收功能的细胞,目前研究破骨细胞分化的经典细胞系包括小鼠 RAW264.7 单核巨噬细胞系与小鼠原代 BMMs 细胞系。
其中 RAW264.7 细胞是 Abelson 鼠白血病病毒诱导 BALB/c 小鼠肿瘤生成后,收集小鼠腹水中单核样巨噬细胞得到的细胞株,被广泛应用于细胞生物学和免疫学研究中。RAW264.7 细胞突破了原代单核巨噬细胞不能增殖传代的限制,并且通过 RANKL 诱导获得的 RAW-OCs 骨吸收能力与 RANKL 诱导 BMMs 分化形成的破骨细胞相似。
BMMs 属于原代细胞,在体外培养过程需要额外添加 M-CSF 维持其存活,并且BMMs 不能传代,但 BMMs 能够更好的模拟人体内破骨细胞的分化及骨分解功能。
原理
破骨细胞是分化后的终末细胞,没有增殖分裂的能力,在体内是单核巨噬细胞 BMMs 分化而来的。BMMs 细胞表面表达 c-fms 和 RANK 受体,在细胞因子 M-CSF 和 RANKL 的作用下,单核巨噬细胞能够增殖并启动分化。因此在体外培养破骨细胞 RANKL 和 M-CSF 两种细胞因子缺一不可,应先提取 BMMs 并在培养基里添加 M-CSF 和 RANKL 从而启动细胞分化,获得破骨细胞。
用途
用以模拟体内破骨细胞分化过程,获得破骨细胞后对药物进行筛选,探索分化前后细胞通路、基因水平、蛋白水平的变化情况。
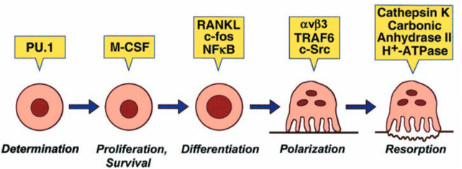
图源自:S. L. Teitelbaum, Science 2000, 289, 1504~1508.
材料与仪器
C57BL/6 小鼠(常用 4~8 周龄,雄性小鼠),alpha-MEM 培养基,双抗
胎牛血清,手术器械,二氧化碳,培养皿,超净台,M-CSF 细胞因子
RANKL 细胞因子、TRAP 染液等
步骤
1. 使用二氧化碳窒息法将小鼠处死,并泡在 75% 乙醇中消毒 10 min。
2. 在动物房超净台中将小鼠下肢的股骨与胫骨剥离,浸泡在 PBS 中。
3. 在细胞房超净台中,将股骨或胫骨两端剪开,刮净骨外膜及其他附着组织,用 1 mL 注射器吸取 Alpha-MEM,轻轻的将针头插进骨的一端,轻柔的冲洗骨髓腔,反复三次直到骨髓腔变白并收集冲下来的培养基。
4. 室温下 1000 rpm 离心 15 min,弃上清液,使用 Alpha-MEM 完全培养基(10% 胎牛血清+双抗)重悬细胞沉淀,并铺在两个 10 cm 细胞培养皿中,细胞放进细胞培养箱中培养 12~24 小时。
5. 第二天弃除细胞上清液和不贴壁的细胞,使用 1000 μL 移液枪吸取 Alpha-MEM 完全培养基轻轻的反复吹打细胞培养皿底,将半贴壁细胞吹下并收集细胞悬液。
6. 室温下使用离心机 1000 rpm 离心 5 min,弃除上清液,收集细胞沉淀,使用 Alpha-MEM 完全培养基(添加 30 ng/mL M-CSF)重悬细胞,并将其进行铺板(以 96 孔板为例),每孔铺 8000 细胞,放进细胞培养箱中培养 12~24 小时,直至多数细胞贴壁。
7. 将 96 孔板中原培养基移除,更换新鲜配置的 Alpha-MEM 完全培养基(30 ng/mL M-CSF 和 30 ng/mL RANKL),放回细胞培养箱中,每 48 小时换液一次,每次换液培养基中均需要新鲜配置额外添加 M-CSF 与 RANKL 的 Alpha-MEM 完全培养基。
8. 约 3 天后,可在光镜下发现出现多核细胞,5~6天 后在显微镜下可以观察到出现了大量具有明显褶皱边缘,多核的「巨大」细胞,使用抗酒石酸酸性磷酸酶染色法对破骨细胞特异表达的 TRAP(抗酒石酸酸性磷酸酶)进行染色,被染色成紫红色,且多核的细胞即为分化成功的破骨细胞。
注意事项
提取骨髓内细胞时动作必须轻柔。在提取当天培养细胞时可以添加 M-CSF 也可以不添加。M-CSF 和 RANKL 细胞因子要尽量选择质量好的试剂公司提供的产品,并保存在 -80 °C。
常见问题
1. 提取细胞后第二天细胞培养液出现浑浊并非污染,而是红细胞不贴壁导致的,只需要将上清液和不贴壁的细胞移除即可,但动作要轻,不然半贴壁的 BMMs 也会有损失。
2. 破骨细胞一般在添加 RANKL 后的第 5~6 天大量出现,此时就应该对细胞进行 TRAP 染色并鉴定,7~8 天之后,破骨细胞会大量死亡。
参考来源:
1. Boyle, W.J., Simonet, W.S. & Lacey, D.L. Osteoclast differentiation and activation[J]. Nature, 2003; 423:337~342.
2. Teitelbaum, S.L. Bone resorption by osteoclasts[J]. Science,2000;289:1504~1508.
来源:丁香实验