相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 英文名:
HBLumi Dual-Luciferase Reporter Assay kit
- 供应商:
汉恒生物
- 保存条件:
-20℃
- 规格:
100rnx
萤光素酶(Luciferase) :是自然界中能够产生生物发光的酶的统称,其中最有代表性的是来自萤火虫体内(Firefly)和海肾(Renilla)体内的两类萤光素酶,荧光素酶可以催化特定的荧光素底物转变成氧萤光素,同时发出强烈的光。
萤火虫萤光素酶(firefly Luciferase,F-Luc), 61kDa,可催化D-荧光素发出萤光
海肾萤光素酶(Ranilla luciferase,R-Luc), 36kDa,可催化腔肠素发出萤光

1.底物存在时,催化底物发出萤光
2.萤光亮度和萤光素酶的量成正比
应用
miRNA和靶基因结合双萤光素酶验证方案
miRNA是一类由内源基因编码的长度约为22 个核苷酸的非编码单链RNA分子,通过靶向结合目的基因的结合位点(通常位于基因的3端非编码区——3UTR区),抑制其上游基因的表达。
鉴于miRNA的特点及luc的特性。 miRNA及其靶结合位点的验证可以通过双荧光实验来实现:包括miRNA与其靶点相关分析,miRNA靶基因验证、lncRNA与circRNA 吸附miRNA验证等
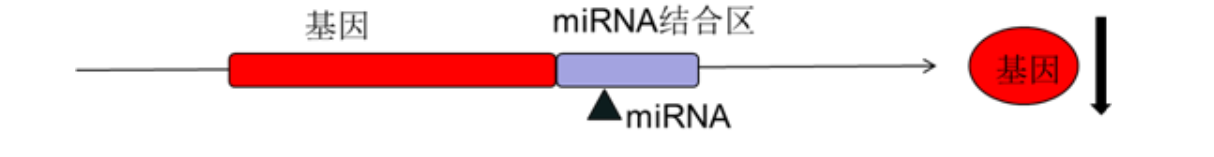
检测原理:
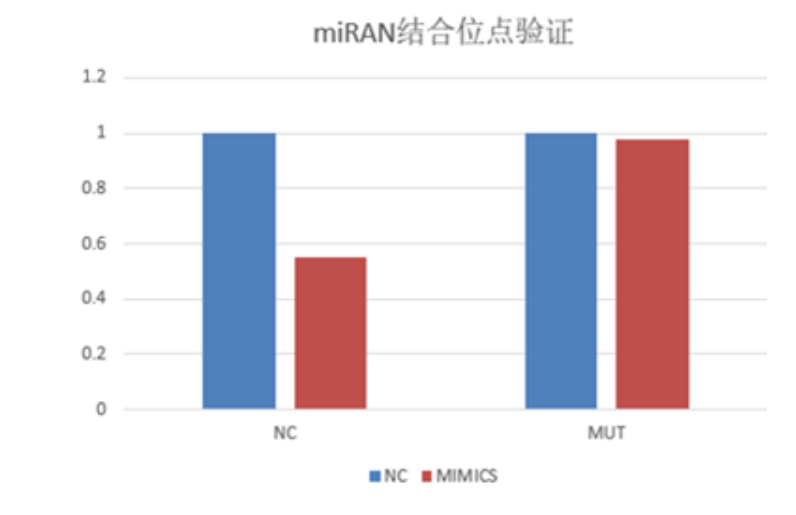
把miR潜在结合构建到报告载体上F-Luciferase下游,将报告载体与 miR的mimics共同转染到细胞内测定荧光素酶值,分析F-Luciferase活性即可反应miRNA与结合位点的结合特性

检测方法及载体工具:
把miR潜在结合位点上下游~500bp(he/或突变位点)构建到荧光素酶报告载体上psiCHECK2的F-Luciferase下游3UTR区,载体上持续性表达R-Luciferase元件作为内参, 与miR的mimics(小片段双链miRNA )/ NC共同转染293T细胞共同转染到细胞内测定荧光素酶值,分析F-Luciferase活性即可反应miRNA与结合位点的结合特性
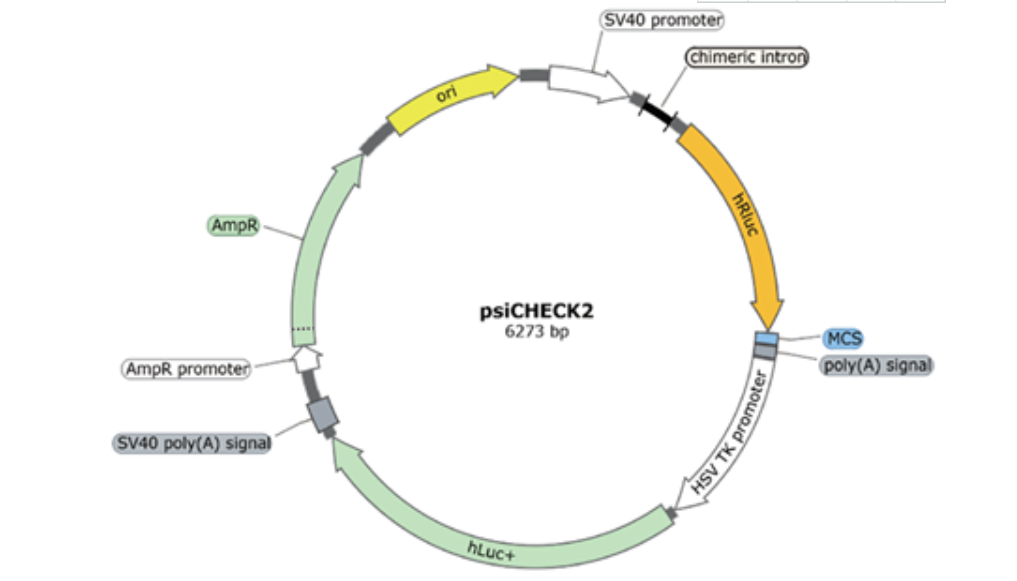
miRNA及靶点验证F-Luciferase报告载体
产品规格
Dual-Luciferase Reporter Assay Kit (100 rxns)
_______________________________________________________________________________
Luciferase Reaction Buffer 10 ml
Luciferase Reaction Substrate (Lyophilized) 1 vial
Luciferase Reaction Buffer II 10 ml
Luciferase Reaction Substrate II(125X) 80μL
实验步骤:
一、细胞转染
转染48 h后收集样检测。
二、荧光检测
1. 将培养箱中的24孔板取出,放在室温,至细胞平衡到室温。
2. 加入细胞裂解液Lysis Buffer,充分裂解后12000rpm 4℃离心10min并转移至96孔板中。
3. 每孔加入F-Luc底物试剂,放入酶标仪中测定记录Firefly luciferase值。
4. 每个孔中加入Stop solution终止F-Luc反应并淬灭F-Luc荧光
5. 每孔加入R-Luc底物放入酶标仪中测定记录Renillaluc luciferase值
6. 计算Firefly luciferase相对荧光值F-Luc/ R-Luc
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验、RNA剪接研究。 萤光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性萤光素酶,一旦转录完成立刻就生成功能性的萤光素酶。单报告基因实验往往会受到各种实验条件的影响,而双报告基因则通过共转染的“对照”作为内参为试验提供一基准线,从而可以在最大程度上减小细胞活性和转染效率等外在因素对实验的影响,使得数据结果更为可信。Dual-Luciferase®双萤光素酶报告基因检测系统在细胞中同时表达萤火虫萤光素酶和海肾萤光素酶,两者没有种源同源性并对应不同的反应底物,故而没有交叉干扰。得益于超强的光
【求助】研究一个基因的5‘非翻译区是否含有低氧转录因子的结合位点,请指教
luoqq1985 这里做基因调控区的前辈一定不少,希望能给点意见,我在研究一个基因的5‘非翻译区是否含有低氧转录因子的结合位点,前期的工作是通过软件分析该区域是否存在这个结合位点的疑似序列,然后将这疑似的序列构人到PGL-3sv40中,转染细胞,经过低氧处理(低氧转录因子会增加)检测双萤光素酶的表达变化。如果有,还可以通过突变碱基进一步确定,但是如果不存在这样的结合位点,那我构出来的这个调控区质粒,不知道还可以做点别的什么试验?
示例: Jurkat细胞用1μM喜树碱(Camptothecin) (左)或未加药 (右)处理4h,FITC-Annexin V/PI荧光双染细胞凋亡检测试剂盒染色后,流式细胞仪荧光检测。 Annexin V-FITC单阳性细胞为早期凋亡细胞,Annexin V-FITC和PI染色双阳性的细胞为坏死细胞或者晚期凋亡。PI单染色阳性位裸核细胞。 实测数据可能会因细胞类型、细胞凋亡情况,检测仪器等的不同而存在差异,图中数据仅供参考。 流式检测细胞凋亡的数据分析方法: 1) 选中所有颗粒,将FSC