相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 规格:
96
NovoNGS DNA Library FlashPrep Kit for Illumina是针对Illumina高通量测序平台开发的专用试剂盒,可将DNA制备成Illumina高通量测序平台专用的测序文库。该试剂盒采用新型的体外转座技术,只需5分钟即可一步实现DNA的片段化与接头连接,实验操作快速简单,无需经过传统文库制备时的片段化、末端修复、接头连接等繁琐步骤。本试剂盒适用于50ng起始DNA量的基因组文库制备。
特点:
快速、简单、DNA用量少。
质量控制:
试剂盒中提供的所有试剂都经过严格的质量控制和功能验证,最大程度上保证文库质量的稳定性和重复性。
适用范围:
适用于将DNA制备成Illumina高通量测序平台专用文库。
产品组成:
| Component | A包装(24 rxns) | B包装(96rxns) |
| NovoTn5 Mix | 72μl | 288μl |
| 5×Reaction Buffer | 160μl | 640μl |
| 5×Stop Buffer | 200μl | 800μl |
| 2×Amplify Mix | 600μl | 2400μl |
保存条件:
除5×Stop Buffer室温保存,其余组分-20℃保存。
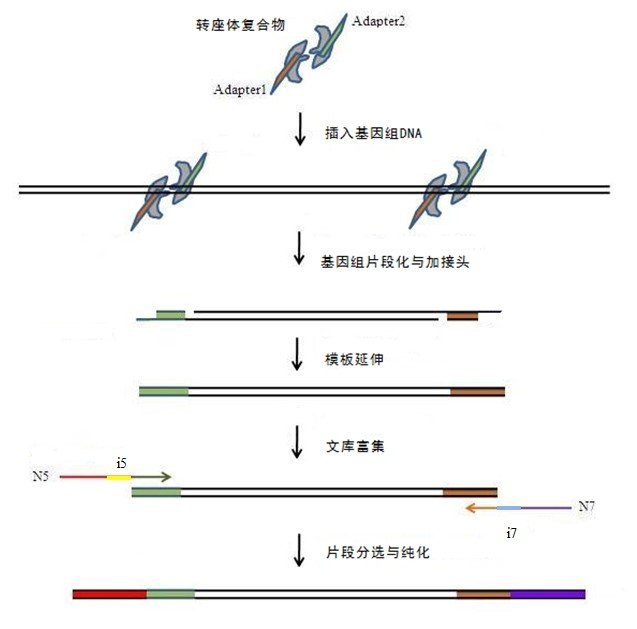
建库原理及流程:
转座酶与两种等摩尔量的接头Adapter1及Adapter2混合形成转座复合体。在55℃条件下孵育5min,转座复合体便能一步实现基因组DNA的片段化与加接头两个过程。纯化后的片段化产物经N5xx/N7xx引物(NovoNGS Index Kit for Illumina,提供8种N5引物及12种N7引物的选择,目录号:N237)扩增后,再经过磁珠分选,便可得到测序文库。建库原理及流程示意图如下:
文库结构:
5’-AATGATACGGCGACCACCGAGATCTACAC-Index2(i5)-TCGTCGGCAGCGTCAGAT
GTGTATAAGAGACAG-xxxxxxxxx-CTGTCTCTTATACACATCTCCGAGCCCACGAGAC-Index1(i7)-ATCTCGTATGCCGTCTTCTGCTTG-3’
文库结构:
5’-AATGATACGGCGACCACCGAGATCTACAC-Index2(i5)-TCGTCGGCAGCGTCAGAT
GTGTATAAGAGACAG-xxxxxxxxx-CTGTCTCTTATACACATCTCCGAGCCCACGAGAC-Index1(i7)-ATCTCGTATGCCGTCTTCTGCTTG-3’
Adapter1和Adapter2:转座复合物中包被的两种接头,分别带有N5/N7引物识别序列及转座酶识别序列,文库打断的同时会添加到DNA片段两端
i5和i7:分别代表Index2(i5)和Index1(i7),均为8 bp
N5和N7:分别携带Index2(i5)和Index1(i7)的引物
-xxxxxxxxx-: 插入序列
操作流程:
适用于将DNA制备成Illumina高通量测序平台专用文库。
- 实验耗材准备
- 起始DNA的准备与要求
- 实验流程:
- 于室温融解5×Reaction buffer,上下颠倒混匀后备用;从4℃取出磁珠,室温静置30min备用。
- 在灭菌PCR管中依次添加各反应组分:
| 5×Reaction buffer | 4μl |
| DNA | 50ng |
| NovoTn5 Mix | 3μl |
| ddH2O | To 20μl |
- 将样品置于PCR仪中,反应程序设置如下:
| 105℃ | 热盖 |
| 55℃ | 5min |
| 10℃ | 10min |
- 从PCR仪中取出样品,加入5μl Stop Buffer, 移液器轻柔吹打混匀后再次放回PCR仪,55℃孵育5min后取出。
- 片段化产物纯化
- 涡旋振荡磁珠,使其充分混匀后,吸取25μl磁珠加入25μl片段化后的产物中,用移液器轻轻吹打10次,充分混匀,室温孵育5 min。
- 若管壁上有液体,将反应管短暂离心后置于磁力架,使磁珠与液体完全分离,约5 min,小心移除上清。
- 向反应管中加入200μl新鲜配制的80%乙醇漂洗磁珠,室温孵育30sec后,用枪头小心移除上清,此过程保持PCR管始终置于磁力架中。
- 重复步骤(3)一次。
- 保持PCR管置于磁力架上,打开管盖,室温空气干燥5 min左右,切记不可干燥过度。
- 从磁力架上取下PCR管,加入22μl无菌超纯水洗脱,移液器轻轻吹打混匀,后室温孵育3min;
- 若管壁有液体,将反应管短暂离心后置于磁力架,室温静置约2 min,使磁珠与液体完全分离,吸取20μl上清至新的PCR管中。
Step2:PCR扩增
- 将灭菌PCR管置于冰浴中配置50μl反应体系
| 2×Amplify Mix | 25μl |
| Step1产物 | 20μl |
| N5xx | 2.5μl |
| N7xx | 2.5μl |
- 移液器轻轻吹打,充分混匀。
- PCR扩增程序如下:
- 72℃* 3min
98℃ 30sec
98℃ 15sec
60℃ 30sec 5-7cycles
72℃ 90sec
72℃ 5min
10℃ Hold
72℃*孵育3min为链置换反应,此步骤不可省略。
PCR循环数多则文库产量高,但对应Duplication会增多,请根据测序需要进行选择。不同循环数对应的文库产出请参照附表一。
Step3:扩增产物长度分选
如对文库长度分布无特殊要求,可直接使用1.0×磁珠纯化文库扩增产物,不需进行片段分选。本步骤采用磁珠两步分选法对扩增产物进行长度分,请优选Novoprotein DNA Screen Beads (货号:N240),如使用其他品牌磁珠,使用方法请以该品牌说明书推荐的体系为准。文库平均总长度 ~350bp ~450bp ~550bp ~680bp 文库平均插入长度 ~220 bp ~320 bp ~420 bp ~550bp 第一轮磁珠用量V1 0.7× 0.6× 0.55× 0.45× 第二轮磁珠用量V2 0.2× 0.15× 0.15× 0.15×
举例:“0.7×”代表磁珠与PCR产物的体积比,若PCR产物体积为50μl,则第一轮磁珠用量0.7×50μl =35μl,第二轮磁珠用量为:0.2×50μl=10μl。
注意:由于PCR过程中水分蒸发导致PCR产物体积小于50μl,请务必用ddH2O补齐至50μl,否则会导致分选长度和预期不一致。
片段筛选: - 涡旋振荡混匀磁珠后,吸取V1体积磁珠加入50μl PCR产物中,使用移液枪轻轻吹打充分混匀,室温孵育5 min;
- 将反应管短暂离心后置于磁力架,使磁珠与液体分离(约5 min,溶液澄清后),
- 小心转移上清至干净的EP管中,丢弃磁珠;
- 涡旋振荡混匀磁珠后,吸取V2体积磁珠至上清中,使用移液枪轻轻吹打充分混匀,室温孵育5 min;
- 将反应管短暂离心后置于磁力架,使磁珠与液体分离(约5 min,溶液澄清后),小心移除上清;
- 加入200μl新鲜配制的80%乙醇漂洗磁珠,室温孵育30sec后,小心移除上清,此过程仍保持反应管置于磁力架中;
- 重复步骤(5)一次;
- 保持反应管置于磁力架中,打开管盖,室温晾干约5min,切记磁珠不要干燥过度;
- 将反应管从磁力架上取下,加入22μl无菌超纯水洗脱,吹打混匀或涡旋混匀后室温孵育3min;
- 将反应管短暂离心后置于磁力架,使磁珠与液体完全分离(约2 min,溶液澄清后),小心吸取20μl上清至新的无菌PCR管内中,-20℃保存。
- 附表一:
注:此处文库产出总量为未进行长度筛选时的结果。PCR扩增循环次数 4 5 6 7 文库产出总量(ng) 250 420 800 1300
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验Native Chromatin Preparation and Illumina/Solexa Library Construction
DNA Repair and Solexa Library Construction 39. Repair DNA ends to generate blunt-ended DNA using the DNA End-Repair Kit (Epicentre). Combine: 1-34 µL of DNA (0.3 µg) 5 µL of 10X End-Repair
Multiplex Illumina Sequencing Using DNA Barcoding
cell. The quality and quantity of purified library DNA can be evaluated by qPCR and Bioanalyzer analyses, respectively. DNA libraries are then ready for mixing and Illumina sequencing. When mixing libraries with severe primer dimer contamination
Digital Gene Expression by Tag Sequencing on the Illumina Genome Analyzer
Basic Protocol 4: Preparing the Library for Illumina Sequencing Alternate Protocol 1: Amplified Tag‐seq Library Construction (Tag‐seqLite) Basic Protocol 5: Data Analysis
 技术资料
技术资料暂无技术资料 索取技术资料