相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 服务名称:
CRISPR/Cas9/基因编辑/sgRNA
- 提供商:
OBiO和元生物
CRISPR/Cas9/基因编辑/sgRNA/AAV/腺相关病毒
服务简介:
基因组编辑技术目前常用的是CRISPR/Cas9和TALEN,而CRISPR/Cas9被使用的更为广泛。通过设计sgRNA(short guide RNA),以引导Cas9对DNA的定点切割,造成DNA双链的断裂,然后细胞可以利用非同源末端连接(Non-homologous End Joining,NHEJ)或者同源重组(Homologous Recombination, HR)方式实现基因敲除或对基因精确编辑的目的。
腺相关病毒具有感染温和,免疫原性小,长效稳定表达的特点。AAV的主要应用方向在于定位注射和整体注射实验。不同血清型的AAV组织感染嗜亲性各不相同,表现出一定的器官靶向特异性,可以参考腺相关病毒的组织嗜亲性表格。
根据客户提供的基因信息,设计sgRNA序列,再将sgRNA片段构建到腺相关病毒载体,生产的病毒颗粒可以直接用于感染细胞或者动物实验。
服务流程:

服务优势:
对分裂期细胞和非分裂期细胞均有感染作用;
低免疫原性,安全性高;
实验周期短。
Cas9可供选择的载体:
| 载体名称 | 载体特点 | 应用方式 |
| pAAV-miCMV-Cas9 | 腺相关病毒 | Cas9质粒现货 |
| pAAV-U6-sgRNA-CMV-EGFP | 腺相关病毒 | sgRNA表达 |
其他相关应用
光遗传 化学遗传 神经环路示踪 钙离子成像 CRISPR/Cas9
Cre-LoxP RNA干扰 基因过表达 microRNA表达 microRNA抑制
基因组编辑技术是一种通过同源重组手段定向改造基因组的技术,是进行基因组改造和探索基因功能的关键手段,包括基因敲除、外源基因定点插入、基因定点突变,以及染色体大片段的重排和删除等。传统的靶向基因组编辑技术主要依赖于基因同源重组,利用设计的同源臂替代靶基因片段,从而达到基因敲除的目的,但是同源重组在细胞中的发生概率极低,而且步骤比较复杂、耗时间、费用也比较高。
近几年出现了很多新型基因组编辑工具,如锌指核酸酶(zinc finger nucleases,ZFN)、类转录激活因子效应物核酸酶(Transcription activator-like effector nuclease,TALEN)以及CRISPR/Cas9技术。利用ZFN、TALEN以及CRISPR/Cas9技术可以在特定位点产生基因组双链DNA断裂(double-strand breaks,DSB),通过非同源末端连接(non homologous end joining, NHEJ)诱发DNA的错误修复,进而形成各种基因大段删除或重排(图1)。其中,CRISPR/Cas9技术由于构建简单、成本低、效率高等特点,自发明以来,迅速被研究人员广泛应用于各类科学研究中,成为了当今生命科学研究的热门技术。
作为又新又“火”的基因组编辑技术,CRISPR/Cas9技术被评为2013年生物学十大突破,2014年值得关注的技术。该技术的发明者之一,麻省理工大学的张锋教授2013年被Nature杂志评为十大人物。
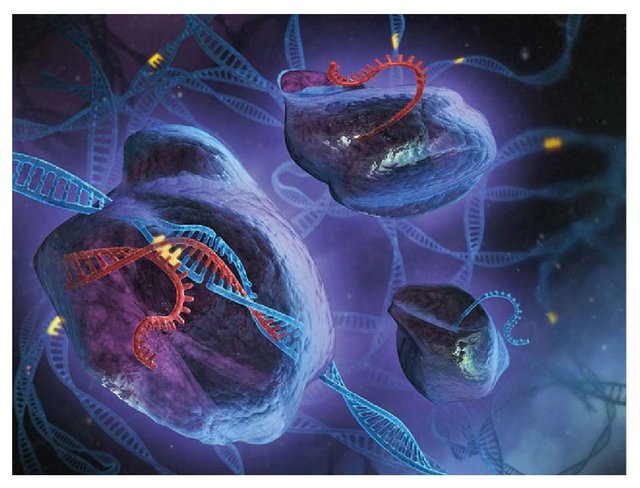
图1. CRISPR/Cas9技术示意图
CRISPR/Cas9技术简介
不论是ZFN技术还是TALEN技术,其介导的基因定向打靶都依赖于DNA特异性结合蛋白的合成,由于这一步骤繁琐、耗时、花费高,因此限制了ZFN和TALEN的应用。而CRISPR/Cas9技术能够介导由RNA导向的DNA识别及编辑,使用一段序列特异性向导RNA分子(sequence-specific guide RNA,gRNA)引导核酸内切酶到靶点处,从而完成基因组的编辑,该系统制作简单、成本低、作用高效,为构建更高效简便的基因组编辑技术提供了全新的平台。
CRISPR/Cas系统早期是在细菌的获得性免疫系统中发现的。规律性重复短回文序列簇(clustered regularly interspaced short palindromic repeats, CRISPR) 是一类独特的DNA规律性重复序列,存在于大多数的细菌和古细菌中。通常在临近CRISPR的区域还包含一组保守的蛋白质编码基因,被称为Cas(CRISPR-associated)基因,其编码的蛋白质包括核酸酶、聚合酶、解旋酶,具有与核糖核酸结合的功能。这些Cas蛋白与CRISPR转录出的RNA结合形成核糖核蛋白复合物,在原核生物中发挥着获得性免疫功能,使宿主获得抵抗噬菌体、质粒等外来DNA入侵的免疫能力。
一般来说,当外源DNA片段入侵后,宿主会捕获一段20bp左右的DNA片段(被称为protospacer),将其插入到自身的基因组中,形成CRISPR区域,在TypeIICRISPR/Cas系统中,主要由Cas9蛋白、反式激活 crRNA(trans-activating crRNA, tracrRNA)和 CRISPR-derived RNA(crRNA)组成。CRISPR区域首先转录成前体RNA(pre-crRNA),在Cas9蛋白的参与下加工成一段含保守重复序列和间隔区的成熟crRNA,同时,tracrRNA也会被转录并和crRNA形成一种双链的RNA结构,然后与Cas9蛋白组成具有DNA内切酶活性的复合物。该复合物在crRNA的引导下,由Cas9蛋白的核酸结构域对外源DNA进行切割(图2)。其中,tracrRNA结合DNA序列的位置是protospacer和PAM(protospacer-adjacent motif)序列,CRISPR/Cas9系统的切割位点依赖于crRNA互补序列下游的PAM序列,该序列对于靶位点的识别和切割是必需的,在每4~8 bp的随机DNA序列中就重复出现一次,因此对于靶位点的设计还是相对容易的。
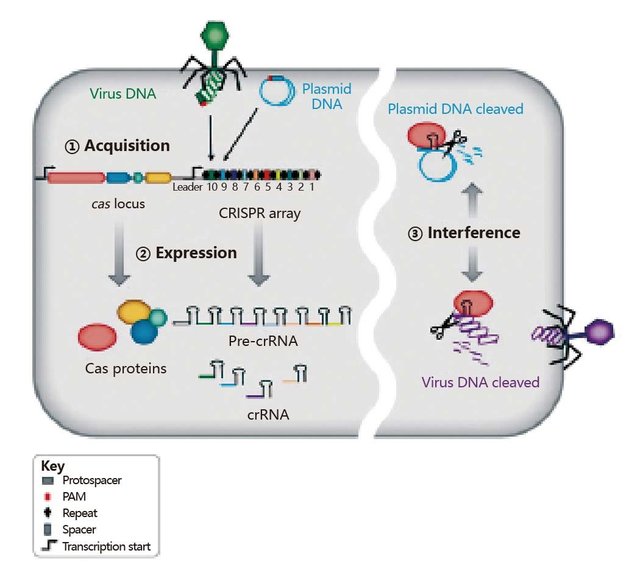
图2. CRISPR/Cas9适应性免疫系统的特性
研究发现,将pre-crRNA和tracrRNA构建成一个融合RNA(single-guide RNA, sgRNA)来模拟成熟的crRNA和tracrRNA,导入细胞后同样可以与Cas9蛋白共同作用特异地切割目的DNA,从而将CRISPR/Cas9系统简化成Cas9蛋白和sgRNA两个组分,来实现对特定靶向位点的切割。
CRISPR/Cas9技术的操作步骤
通过人工设计tracrRNA/crRNA,可以改造成具有引导作用的sgRNA,以引导cas9对DNA的定点切割,造成DNA双链的断裂,然后细胞可以利用NHEJ或者同源重组的方式实现基因敲除或对基因精确编辑的目的,CRISPR/Cas9技术的应用主要包括以下几个关键步骤(图3):
1.靶基因分析:根据靶基因的名称和种属信息,在NCBI、Ensembl Genomes或其他分子生物学网站上进行查找,搜索到该基因的信息,并明确CDS外显子部分;
2.sgRNA位点设计:确定待敲除位点,对于蛋白编码基因,如果该蛋白具有重要结构功能域,可考虑将基因敲除位点设计在编码该结构域的外显子;如果不能确定基因产物性质,可选择将待敲除位点放在起始密码子ATG后的外显子上。如果是microRNA,可以将待敲除位点设计在编码成熟microRNA的外显子或在编码成熟microRNA的外显子的5’和3’侧翼序列。选择好要设计的区域后,再通过预测网站进行序列预测。序列预测的目的主要是避免Cas9脱靶效应,以确保设计的sgRNA尽可能的减少脱靶效应;
3.Cas9载体构建:根据sgRNA序列,安排引物合成。引物合成时,需要在引物的5’端引入粘性末端。将引物退火形成带粘性末端的双链片段,取1ul用于后续的连接反应,其余在-20℃下保存。对表达载体先进行限制性内切酶酶切,得到线性化载体,再把前面得到的双链片段连接入表达载体。再进行感受态细胞的转化和阳性转化子的鉴定;
4.Cas9载体活性检测:对于构建的Cas9载体,转染细胞进行重组效率的检测,检测的方法主要是采用特异性片段扩增后进行的T7E1酶切处理,这一方法可以特异、定量的检测基因组重组效率。
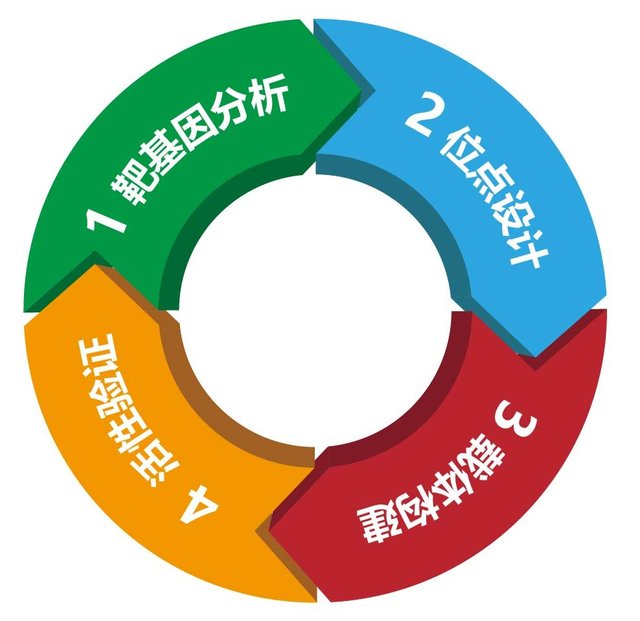
图3. CRISPR/Cas9技术的应用流程
CRISPR/Cas9技术优点
作为被称为第三代基因编辑技术的CRISPR/Cas9系统,相比于ZFN系统和TALEN系统,它有着如下优点:
1.可用位点更多:理论上基因组中每8个碱基就能找到一个可以用CRISPR/Cas9进行编辑的位点,可以说这一技术能对任意基因进行操作,而TALEN和ZFN系统则在数百甚至上千个碱基中才能找到一个可用位点,大大限制了使用范围;
2.具有可拓展性:例如可以通过对Cas9蛋白的修饰,让它不切断DNA双链,而只是切开单链,这样可以大大降低切开双链后带来的非同源末端连接造成的染色体变异风险。此外还可以将Cas9蛋白连接其他功能蛋白,从而在特定DNA序列上研究这些蛋白对细胞的影响;
3.使用极为方便:只需要简单的几步就能完成,几乎任何实验室都可以开展工作,因此省时省力;
4.可同时对几个基因进行操作:利用CRISPR/Cas9技术可以非常高效地对多个基因进行敲除,这一特点在针对多基因突变而引起的疾病研究中将发挥重要作用。
CRISPR/Cas9工具在神经系统中的应用
1.基因敲除:如果利用Cas9-sgRNA进行切割产生DNA双链断裂后,神经元会通过非同源末端连接(non-homologous end joining,NHEJ)方式修复DNA,则核酸链被剪切的区域会发生基因突变,导致编码基因的敲低或敲除(图4)。
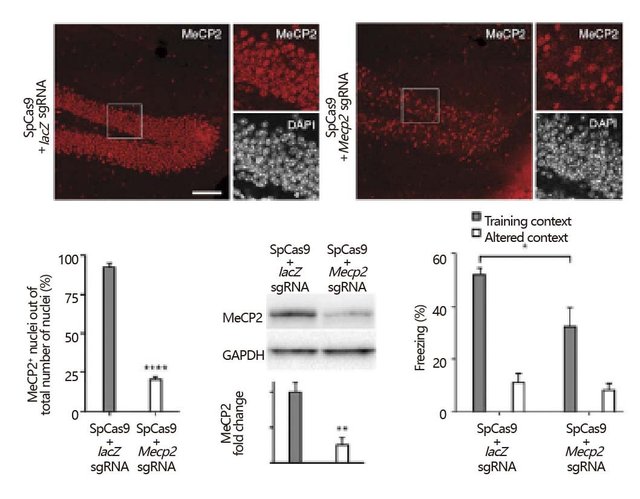
图4. AAV递送Cas9对海马齿状回Mecp2的影响
2.基因敲入:CRISPR/Cas9系统中的Cas9-sgRNA在靶位点进行切割产生DNA双链断裂后,如果细胞通过同源重组(homology-dependent repair,HDR)方式修复DNA,则目的基因会插入到断裂位点,导致细胞编码目的基因。但相比其他系统,要在神经系统实现基因敲入的主要限制是HDR在终末分化神经元的发生概率,因此寻找能触发HDR在神经元有效发生的信号通路是关键。
3.在神经系统疾病模型建立及治疗研究中的应用:过去几年研究人员利用CRISPR/Cas9技术对大脑发育和神经性疾病中起到重要作用的基因进行剪切。相比脆性X染色体综合症是由单个基因突变造成,而像精神分裂症由多基因发生突变显得更复杂。CRISPR/Cas9技术无疑是研究由多基因突变引起的孤独症、抑郁症、强迫症等神经疾病的好技术。例如,如果发现Huntington基因中特异片段突变造成了Huntington综合症,我们就将突变片段通过CRISPR/Cas9技术编辑到小鼠胚胎中,然后就能研究它们的行为和生理变化,从而判断这类小鼠是否有Huntington综合症的表象,还能给它们相关药物,观察是否能够缓解Huntington综合症的症状(图5)。
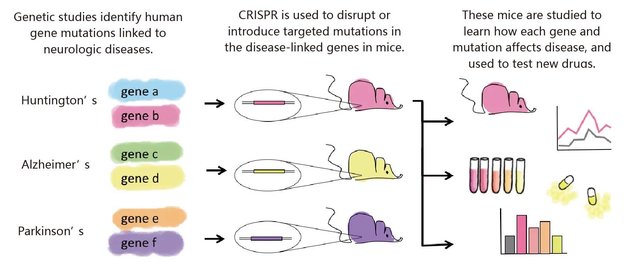
图5. 利用CRISPR/Cas9技术研究神经系统疾病的流程示意图
如果有不止一个基因突变导致了病变,如精神分裂症,也能够通过设计多引导RNA(或者DNA模板)同时诱导更多突变位点进入小鼠胚胎(图6)。
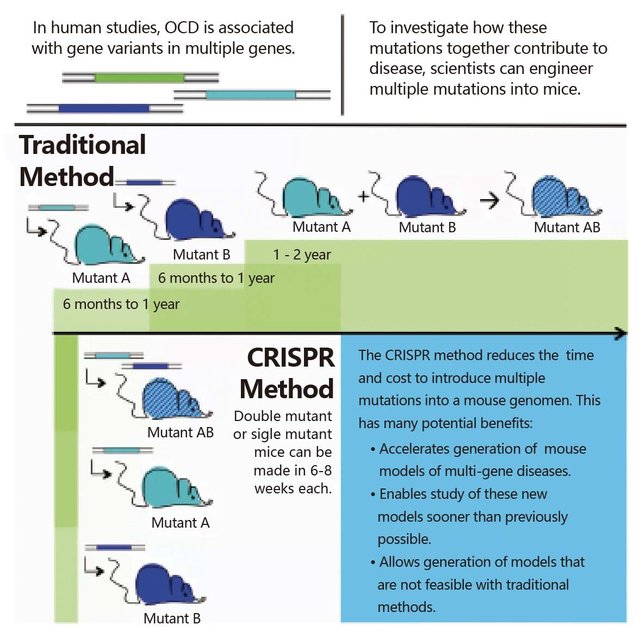
图6. CRISPR/Cas9构建多基因突变疾病模型
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验CRISPR/Cas9 是一种强大的基因组编辑工具,今天我们介绍 CRISPR/Cas9 系统操作。以下操作说明是基于作者冰糖个人实验室操作,仅供参考。 质粒介绍我们使用的是 Feng Zhang 实验室的系统的 pX330 质粒,如下图所示: 酶切系统 37 ℃, 3 hr;Run 1% gel,回收。Elute 到 50 mL H2O。我们利用 BbsI 消化载体形成粘末端,以利于下游 oligo 退火产物的连接;酶切时请充分,且绝对不能加 CIP 处理
选育新方法。而 CRISPR-Cas9 技术的出现,更是极大推动了微生物基因组编辑准确性和效率的提高。【背景】泓迅科技利用 CRISPR-Cas9 技术编辑酵母菌中的一个 920bp 的 ADE1 基因。ADE1 是腺嘌呤合成相关基因,如果 ADE1 失活,则细胞将会积累红色色素,呈现红色菌落。【方法】1、质粒构建2、sgRNA 活性检测3、挑选活性较高的 sgRNA 进行基因组定点编辑4、利用基因功能变化、表性变化和测序等方法检测基因定点修饰结果。【结论】1、从颜色表型变化得知,酵母菌落变成红色菌落,可知 ADE
以最火热的 p53 为例Step1 先找 p53 基因序列1. NCBI--输入 p53 并选择物种 human:tumor protein p53 [Homo sapiens (human)]https://www.ncbi.nlm.nih.gov/gene2. Ctrl+F,输入 sequence,快速定位(当然其实拉下去就是了),点击 Genebank3. 下载 p53 基因序列4. 用 SnapGene 软件打开序列,并简单了解每个元件最好是可以学一下 SnapGene 这个软件的使用
 技术资料
技术资料暂无技术资料 索取技术资料