相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 服务名称:
CRISPR/Cas9基因编辑
- 提供商:
吉奥蓝图
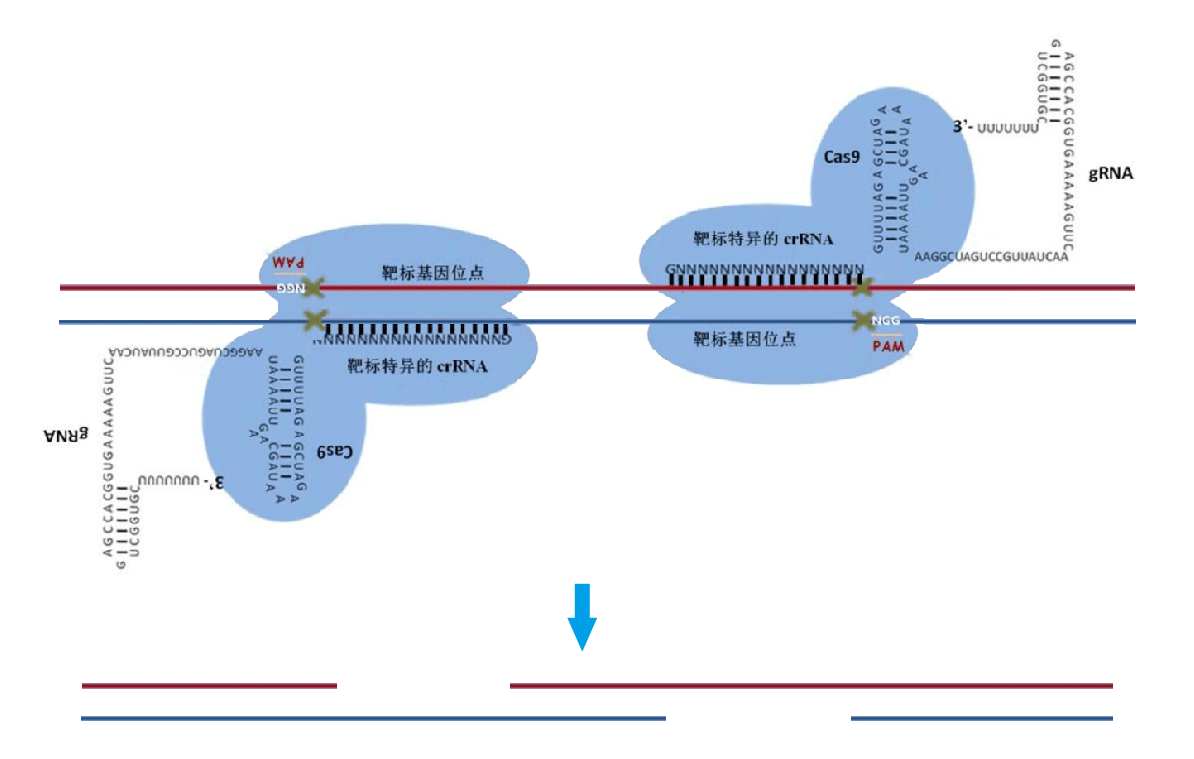
此系统的工作原理是crRNA(CRISPR-derived RNA)通过碱基配对与 tracrRNA(trans-activating RNA)结合形成tracrRNA/crRNA复合物,此复合物引导核酸酶 Cas9蛋白在与crRNA 配对的序列靶位点剪切双链DNA。而通过人工设计这两种 RNA,可以改造形成具有引导作用的sgRNA(short guide RNA ),足以引导Cas9对DNA的定点切割。作为一种RNA导向的dsDNA结合蛋白,Cas9效应物核酸酶是已知的第一个统一因子(unifying factor),能够共定位RNA、DNA和蛋白,从而拥有巨大的改造潜力。将蛋白与无核酸酶的Cas9( Cas9 nuclease-null)融合,并表达适当的sgRNA ,可靶定任何dsDNA序列,而sgRNA的末端可连接到目标DNA,不影响Cas9的结合。因此,Cas9能在任何dsDNA序列处带来任何融合蛋白及RNA,这为生物体的研究和改造带来巨大潜力。
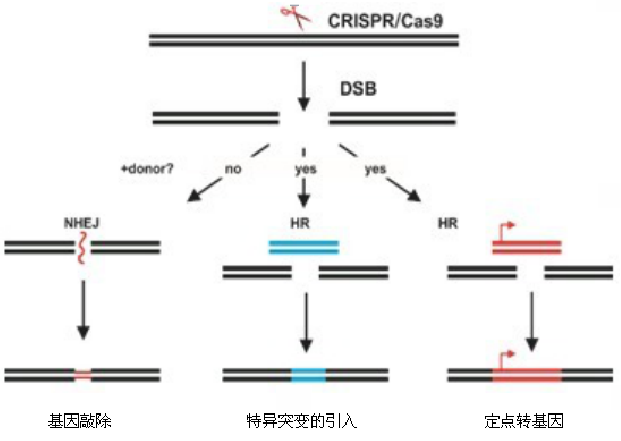
通过CRISPR/Cas9技术可以进行以上三种基因组改造, 实现基因编辑。
CRISPR/Cas9由于其构建简单方便,成功率高,可以实现多基因敲除,而且有可能直接得到纯合子突变体,因此得到众多科研人员的青睐。尽管最初报道CRISPR/Cas9系统具有很高的特异性,研究者宣称即便是一个核苷酸的错配都可以阻止CRISPR-Cas9继续发挥作用,但是麻省总医院的研究人员却发现,在人类细胞系中,多达5个核苷酸的错配都未必阻止目标位点外的切割(High-frequencyoff-target mutagenesis induced by CRISPR-Cas nucleases in human cells, NatureBiotechnology, 2013 Sept; 31:822-6)。他们还发现,脱靶位点的突变率与目标位点的突变率相同甚至更高,而这种现象未见于ZFN和TALEN技术。显然CRISPR/Cas9的脱靶问题将会严重限制其应用。
为了减弱甚至消除脱靶效应,科学家进行了不同的尝试。哈佛医学院的George Church研究小组制备了一系列的Cas9突变体(nickases),这些Cas9突变体不能使DNA双链断裂,而只是引入了偏移缺口,每个缺口只影响一条DNA链,这样它通常不会导致非同源末端连接(NHEJ)引起的插入或删除。
因此,这种方法可能会减少脱靶效应 (Cas9 transcriptional activators for targetspecificity screening and paired nickases for cooperative genome engineering,Nature Biotechnology, 2013, Sept; 31: 833-8)。由于CRISPR/Cas9与靶位点识别的特异性主要依赖于gRNA与靠近PAM处10-12bp碱基的配对,而其余远离PAM处8-10bp碱基的错配对靶位点的识别影响不大。
麻省总医院的J.KeithJoung研究组系统研究了去除远端碱基对gRNA结合靶点的影响,他们发现含17或18个碱基的gRNA具有与全长的gRNA相同的(甚至更高的)靶点结合能力,而长度为15或16碱基的gRNA与靶点的结合力则大大降低甚至丧失。更进一步的研究显示含17个碱基的truncatedCRISPR/Cas9可以往人细胞系的靶点有效的导入突变,而脱靶效率则大大降低,有些位点的脱靶效率降低高达5000倍。
这一研究发表于2014年1月26日的Nature Biotechnology上(ImprovingCRISPR/Cas Nuclease specificity using truncated guide RNAs,Nature Biotechnology,2014,Jan.26)。而且truncatedgRNA与Nickases结合可以更进一步降低脱靶。
为了进一步降低脱靶效率,本公司也采用了Nickases双切的技术,使用的一种Cas9突变体只切一条链,设计两条gRNA同时引入两个位置接近的偏移缺口,分别位于不同的DNA链上,从而引入突变。
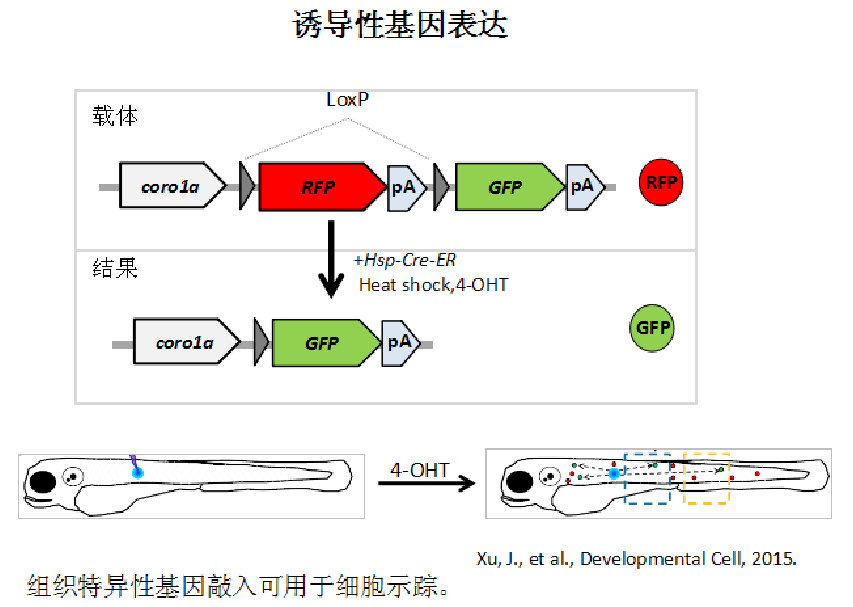
Cre-LoxP系统
Cre重组酶基因编码区序列全长1029bp(EMBL数据库登录号X03453),编码38kDa蛋白质。Cre重组酶是一种由343个氨基酸组成的单体蛋白。它不仅具有催化活性,而且与限制酶相似,能识别特异的DNA 序列,即loxP位点,使loxP位点间的基因序列被删除或重组。Cre重组酶有70%的重组效率,不借助任何辅助因子,可作用于多种结构的DNA底物,如线形、环状甚至超螺旋DNA。它是一种位点特异性重组酶,能介导两个LoxP位点(序列)之间的特异性重组,使LoxP位点间的基因序列被删除或重组。Cre重组酶是位点特异性重组酶,能介导两个LoxP位点之间的特异性重组,使LoxP位点间的DNA序列被删除或重组。
Cre重组酶介导两个LoxP位点间的重组是一个动态、可逆的过程,可以分成三种情况:
1.如果两个LoxP位点位于一条DNA链上,且方向相同,Cre重组酶能有效切除两个LoxP位点间的序列。
2.如果两个LoxP位点位于一条DNA链上,但方向相反,Cre重组酶能导致两个LoxP位点间的序列倒位。
3.如果两个LoxP位点分别位于两条不同的DNA链或染色体上,Cre酶能介导两条DNA链的交换或染色体易位。

基于Cre-LoxP的基因打靶要分两步来进行。首先要在胚胎干细胞的基因组中引入LoxP序列,这一步可以通过打靶载体的设计和对同源重组子的筛选来实现。下一步通过Cre介导的重组来实现靶基因的遗传修饰或改变。
Cre-LoxP系统既可以在细胞水平上用Cre重组酶表达质粒转染中靶细胞,通过识别LoxP位点将抗性标记基因切除,又可以在个体水平上将重组杂合子小鼠与Cre转基因小鼠杂交,筛选子代小鼠就可得到删除外源标记基因的条件性敲除小鼠。或者将Cre基因置于可诱导的启动子控制下,通过诱导表达Cre重组酶而将LoxP位点之间的基因切除(诱导性基因敲除),实现特定基因在特定时间或者组织中的失活。
在何种组织细胞或器官中敲除某一特定的基因取决于所选择的启动子。只要选择合适的启动子调控Cre重组酶的表达,使其在生物体特定的部位、特定的条件下产生,就可以实现相应条件下某一特定基因的敲除。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验在最新出版(2016.02)的冷泉港实验指南的头版,详细阐述了 CRISPR-Cas9 系统在小鼠基因编辑中应用。 在现代生物学中,实现对小鼠基因进行编辑或许是最重要的进步之一。然而,传统基因工程手段都很费时费力。可编程核酸酶的使用极大的提高了基因编辑技术的准确性(如,锌指核酸酶、转录激活效应核酸酶),但是这些核酸酶的设计和使用仍然纷繁复杂成本高昂。随着下一代可编程核酸酶系列--CRISPR-Cas9 系统的出现,使得基因编辑的能力更加高效准确,与此同时,该系统所涉及的试剂
祝贺MIT张锋研究组所取得的重要发现,并感谢他们选用来自Sellckchem的高质量产品。 自2013年以来,CRISPR/Cas9成为目前最热的基因编辑系统。MIT的科学家对CRISPR/Cas9进行了改造。现在,科学家可以用这一技术在细胞中有效启动任何基因,更简便地研究不同基因的功能。这一成果发表在2014年12月10日的Nature杂志上。领导这项研究的张锋(麻省理工学院脑与认知科学助理教授、McGovern 脑研究所和Broad研究所核心成员,Feng Zhang,音译张锋)说,改造
CRISPR-Cas9基因编辑技术为人类疾病和基因异常的治疗和预防开辟了无限可能。新闻中的基因编辑最近有几个关于人类胚胎基因编辑的新闻:好的和坏的。CRISPR-Cas9技术是最新最著名的基因编辑技术之一,它的发展导致了一系列利用人类胚胎进行的实验,这些实验将基因编辑的伦理问题推向了前台。它始于2015年,当时一组中国研究人员使用一种名为CRISPR-Cas9的基因编辑技术编辑人类胚胎的基因,试图“移除”导致致命血液疾病(β地中海贫血)的部分DNA(发表在《蛋白质与细胞》杂志上)。最近
 技术资料
技术资料暂无技术资料 索取技术资料