相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 库存:
50
- 英文名:
2×Laemmli Loading Buffer (without DTT)
- 供应商:
上海博尔森生物科技有限公司
- 保存条件:
-20℃
- 规格:
5mL
2×Laemmli上样缓冲液(不含DTT)
产品内容

产品说明:
Tricine-SDS-聚胶电泳(Tricine-SDS-PAGE)是目前电泳法变性分离多肽的主要方法。此试剂可以制备 20/50 块 0.75 mm× 14 cm×14 cm 胶。
使用方法:
推 荐 在 分 离 多 肽 时 使 用 由 4% 浓 缩 胶 、 10% 隔 离 胶 和 16% 分 离 胶 从 上 到 下 组 成 的 三 层Tricine-SDS-PAGE 胶,下面为配制该胶的流程。
1. 配制 30 mL 16%分离胶和 9 mL 10%隔离胶(足够灌两块 0.75 mm× 14 cm×14 cm 胶)。
A) 标记 2 个 50 mL 的三角瓶,按下表的用量加入各成分:
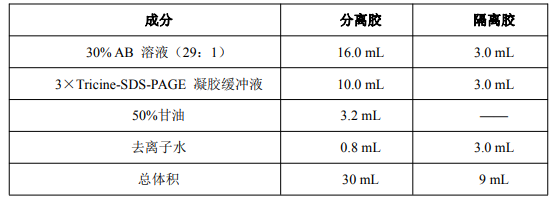
B) 混匀后真空脱气 10-15 分钟。
C) 在分离胶瓶中加入 150 uL 10%的 APS 溶液和 30 uL TEMED 溶液, 轻轻旋转混匀。
D) 灌胶。用一根巴斯德吸管,将分离胶溶液沿着一个隔条的边缘加到玻璃板夹层中,直到溶液的高度
距离玻璃上沿还有 5 cm。由于分离胶比重比隔离胶大,故可在其凝固前直接灌隔离胶。
E) 在隔离胶瓶中加入 75 uL 10%的 APS 溶液和 15 uL TEMED 溶液, 轻轻旋转混匀。
F) 灌胶。用巴斯德吸管,将积层胶溶液缓缓地沿着一侧隔条边缘加入到 玻璃平板夹层中,直到溶液离
玻璃板顶部约 3 cm 高为止。
G) 盖 1cm 高的水饱和的使胶面跟氧气隔绝(氧气会抑制胶的凝固;此处水饱和的可用
水代替,但效果会差一些)。
H) 让分离胶和隔离胶在室温聚合 30-45 分钟。
2. 配制 9 mL 4%浓缩胶(足够灌两块 0.75 mm×14 cm×14 cm 胶)。
A) 在一个 50 mL 的三角瓶中,先按下表的用量加入各成分:
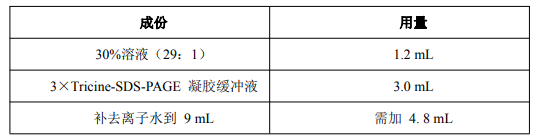
B) 混匀后真空脱气 10-15 min。
C) 将 75 uL 新鲜配制的 10%的溶液和 15 uL TEMED 溶液加 入到溶液中,轻轻旋转混匀。
D) 灌胶。用巴斯德吸管,将积层胶溶液缓缓地沿着一侧隔条边缘加入到 玻璃平板夹层中,直到夹层中的溶液离玻璃板顶部约 1 cm 高为止。
E) 插入 0.75 mm 厚的塑料梳子,再补加浓缩胶溶液填满梳子间的空隙。 注意避免产生气泡。
F) 让浓缩胶在室温聚合 30-45 分钟。
3. 小心拔出塑料梳子,在上层缓冲槽中加入 1×阴极缓冲液,并用 1×阴极缓冲液冲洗加样孔。
注:10×Tricine-SDS-PAGE 阴极缓冲液用去离子水 1:9 稀释成 1×阴极缓冲液。
4. 在电泳装置的下层缓冲液槽中加入 1×阳极缓冲液。
注:10×Tricine-SDS-PAGE 阳极缓冲液用去离子水 1:9 稀释成 1×阴极缓冲液。
5. 在密封的螺盖微量离心管中,用 2×Tricine 多肽上样缓冲液按 1: 1 的比例稀释蛋白样品,于 100℃煮沸 3-5 分钟。
注意:如果样品是蛋白沉淀物,则加入 50-100 uL 新配的 1×Tricine-SDS-PAGE 上样缓冲 液溶解;如果样品是蛋白稀溶液,可先浓缩蛋白质。与 Tricine-SDS-PAGE 上样缓冲液混合后的样品如未经 100℃加热灭活蛋白酶,切勿放于室温。
6. 上样。如果用考马斯亮蓝染色,对于成分复杂的蛋白质样品,上样量最好为 20 uL(含 25-50 ug 总蛋白质);对于只有一种或几种蛋白质的样品, 上样量最好为 1-10 uL。如果用银染,上样量可减少 10-100倍。
7. 电泳。先 30 V 恒压电泳 1 h(对 0.75mm×14cm×14cm 的胶而言), 然后 150 V 恒压电泳 4-5 h。
注:本产品的 Tricine-SDS-PAGE 上样液 使用了考马斯亮蓝 G-250 作为指示剂,其泳动速度比最小的肽还快。
8. 终止电泳,取出凝胶进行后续的实验处理(最好用银染染色,节约样品)。
注意:考染或银染时,基本步骤同蛋白电泳,但任何一步(尤其是固定步 骤)的处理时间都不要超过20 分钟,否则多肽非常容易扩散出 PAGE 胶 而降低检测的灵敏度。
特别提示:本公司的所有产品仅可用于科研实验,严禁用于临床医疗及其他非科研用途!
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验(十二烷基硫酸钠)50 mM Tris-HCl pH 8.0蛋白酶抑制剂Tris-HCl 缓冲液20 mM Tris-HCl pH 7.5蛋白酶抑制剂●电泳、转膜、封闭缓冲液Laemmli 2× 缓冲液/上样缓冲液4% SDS10% 2-巯基乙醇20% 甘油0.004% 溴酚蓝0.125 M Tris-HCl测定 pH 并调节至 pH 6.8。电泳缓冲液(Tris-甘氨酸/SDS)25 mM Tris 碱190 mM 甘氨酸0.1% SDS测定 pH,pH 应为约 8.3。必要时进行调节。转膜缓冲液
于上佳的上样缓冲液中,可产生相等或预期强度的条带,并且不含有条带污点,无染色阴影。与此相反,分子量标准 #1 采用较老技术制造,并存在于次优组分的缓冲液中。 b. 样品和标准品准备 须计算上样到凝胶中的 DNA 量,以确保目的条带良好分离,并用于可视化和检测。虽然用荧光染料足以检测 1 - 100 ng/条带的 DNA,但最小可检测量取决于 所用染料(了解更多: 核酸染色特性)[2]。注意,样品或标准品的超载会造成条带污点并遮盖附近条带,从而导致条带分辨不清,特别是片段大小相似时(图 2A)。 图
下 12000rpm 离心 15 min。收集蛋白上清,取少许裂解液用于后续检测各蛋白表达情况。剩余的裂解液加入 Anti-Cdc37,4℃ 缓慢摇晃孵育过夜。用适量裂解缓冲液预处理 ProteinA+G,20uL/管加入各抗体孵育过夜的细胞裂解液中,4℃ 缓慢摇晃孵育 2~4 h。免疫沉淀反应后,4℃,3000rpm,3 min,小心吸取上清,琼脂糖珠用 1 mL 裂解液冲洗 3-4 次,最后加入 15uL 2*SDS 上样缓冲液,100℃,5 min。Laemmli-SDS-PAGE电泳:电泳时根据情况
 技术资料
技术资料暂无技术资料 索取技术资料










