万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 库存:
50
- 英文名:
Corn Protoplast Preparation and Transformation Kit
- 供应商:
上海博尔森生物科技有限公司
- 保存条件:
RT&-20℃
- 规格:
5T /10T
| 规格: | 5T | 产品价格: | ¥1298.0 |
|---|---|---|---|
| 规格: | 10T | 产品价格: | ¥2378.0 |
玉米原生质体制备及转化试剂盒(20mL/T,电转)
储存条件:A 盒,-20℃储存;B 盒,常温储存。
产品组成
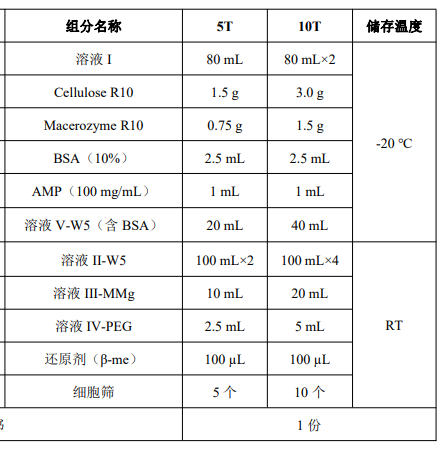
产品简介:
本试剂盒主要通过纤维素酶和离析酶配制的酶解液消化植物细胞壁获得原生质体。适用于从短日照培 养或者生长在培养皿内的番茄幼苗叶片中分离原生质体。获得的细胞可用于蛋白的亚细胞定位,验证蛋白 间的相互作用,研究蛋白的转录调控等。
本试剂盒包含原生质体制备和转化所需的全部试剂,照每次 20 mL 酶解液的使用量,可供 5 次(5T)/10 次(10T)实验。
使用说明:
一、准备工作
1. 需要准备的材料(本试剂盒不提供):
锋利刀片;血球计数板;50 mL 离心管;2 mL 离心管。
2. 即用型酶解液配制
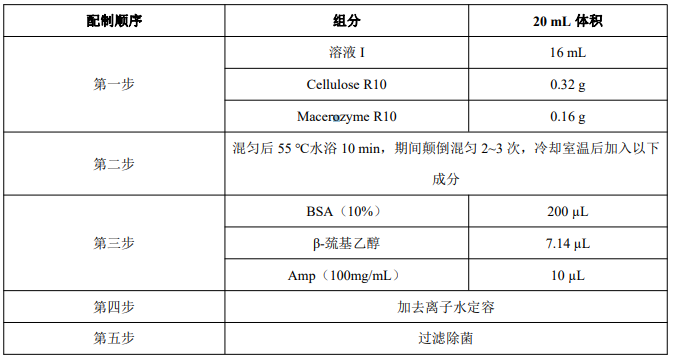
注:根据实验的需要选择酶解液是否需要过滤除菌,在三小时内游离原生质体无需过滤除菌。
二、原生质体的分离制备
1.玉米种子在水中浸泡过夜,种到 1/2 蛭石和 1/2 腐植土中,放在弱光下(30-75 µmole/m2sec)和光照周期小于 12 hr 条件下生长。或在光下生长 3 天,大约能见 1-2cm 的幼芽时,转移到黑暗条件下,直到第二片叶子超过第一片叶子 10-15cm 长。此过程中仅仅浇水,保持土壤湿润,不能加其他营养液,否则不利于后期操作。在黑暗条件下玉米幼苗分离的原生质体要好于光下生长的幼苗。
2.去除第二片叶的尖端和低端,取中间 8-10cm 处,把多片叶片叠在一起,避免用力过大,对叶片造成损伤,用锋利刀片切成 0.5mm 宽的长条。
注:切叶片时可以将 3-5 片叶叠在一起,不要过多,避免拖拽,以防破坏原生质体。
3.切好的玉米细条放入装有 20 mL 酶液的小烧杯中,锡箔纸包裹,烧杯口留洞,抽真空 30 分钟(15Hg/50kpa/0.5)。
4.避光室温 40-50 rpm 摇床上摇动 4h。收集原生质体前,80 rpm 摇动 5min,让细胞完全释放出来(玉米叶片原生质体尺寸大约为 25-35 µm)。
5.酶解后的产物用细胞筛过滤,用镊子或无菌枪头轻轻夹取酶解物帮助充分释放原生质体,去除未消化的叶片组织。用 10 mL 溶液 II-WI solution 冲洗酶解器皿和未消化的叶片 2-3 次,将所有的液体收到 50 mL离心管中。
注:操作过程中尽可能动作要轻柔,避免剧烈震荡,防止原生质体破碎。
6.选用水平转头,150 g 离心 2 min,升速 3,降速 3,去除上清。
注:离心时,可调低离心机的升速和降速。升速过快,原生质体可能离到管壁上;降速过快,可能导致管底原生质体悬起。建议升速和降速分别都使用 3。
7.用 10 mL 预冷的溶液 II-WI solution 温柔重悬位于底部的原生质体,用剪尖的蓝枪头轻轻将原生质体悬起,150 g 离心 2 min,升速 3,降速 3,去上清。
8.加入 1 mL 预冷的溶液 II-WI solution,重悬原生质体, 冰上静置 30 min。
9.在离心前,可以显微镜下观察原生质体的状态和血球计数板计数。
注:如原生质体呈现圆球形,叶绿体分散在整个细胞内,说明状态较好;如呈现不规则形状,说明原生质体破碎或即将破碎。
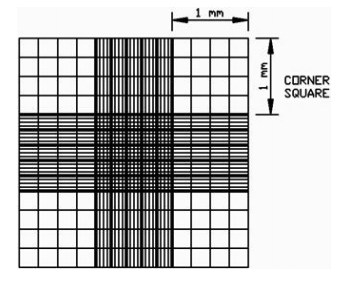
血球计数板的使用:
如下图所示,在血球计数板上加上一个盖玻片,分别从两侧凹槽加入样品。使用中央区域长和宽都是 1 mm 的方形区域进行计数(25 个中方格)。分别统计正方形四个顶角和中央的小正方形的细胞数量,取 平均值再乘以 25(正方形被分成了 25 个小正方形),计算该区域的细胞数量,该区域的体积为 0.1 µL(长 1 mm,宽 1 mm,高 0.1 mm)。计算获得的细胞数量。原生质体浓度(个/mL)=25 个中方格原生质体数 ×104×稀释倍数。
10.150 g 离心 1 min,升速 3,降速 3,去上清,用相应体积的遇冷的溶液 II-WI solution 重悬原生质体,调整原生质体密度为 1-2×
106个/mL。(如细胞量较少,可以将所有细胞用于 1-2 个转化体系)
三、 原生质体的转化和培养
1. 在 2 ml 的圆底离心管中加入 25-50 µg 纯化后的质粒,随后加入 100 µL(1-2×105)已调整好浓度
的原生质体轻轻混匀,用 Solution II 定容到 300 uL。
注:大于 10 KB 的质粒,转化效率会降低。
2. 电击。电击条件 5 msec,400V 和 200 uf,电击一次,如果为了得到更好的转化效率,可以尝试电击两次或三次。
3. 冰上放置 10 min。150g, 离心 2 min, 升速 3,降速 3,去上清。
4. 用 Solution III-孵育液悬浮沉淀,随后转移到六孔细胞培养板。
注:细胞板需要先用 5%牛血清(calf serum)包被 10 sec,防止细胞粘在塑料板上。不可以使用 BSA.5. 在弱光条件下孵育 3-6h 可以用于 RNA 分析;6-24 小时用于蛋白和酶活分析。
注意事项:
1. 分离制备的原生质体没有细胞壁的保护,非常脆弱,整个实验操作过程中动作尽可能的轻柔。
2. 为了避免原生质体离心时贴在管壁,建议整个实验过程使用平角转头。
3. 实验过程中尽可能使用剪尖蓝枪头(1 mL 吸头),因为其尖端的孔径较大;或把黄色枪头的尖端剪掉,并保证平滑。
特别提示:本公司的所有产品仅可用于科研实验,严禁用于临床医疗及其他非科研用途!
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验一. 植物遗传转化的方法 植物遗传转化技术可分为两大类:一类是直接基因转移技术,包括基因枪法、原生质体法、脂质体法、花粉管通道法、电激转化法、PEG介导转化方法等,其中基因枪转化法是代表。另一类是生物介导的转化方法,主要有农杆菌介导和病毒介导两种转化方法,其中农杆菌介导的转化方法操作简便、成本低、转化率高,广泛应用于双子叶植物的遗传转化。二.农杆菌介导的基因转化方法 (一)农杆菌的Ti质粒与T-DNA 的整合机制几乎所有双子叶植物都容易受到土壤农杆菌感染,而产生根瘤。它是一种革兰氏阴性土壤杆菌
不起作用时,最原始也是最有效方法还是原生质体转化。当经过消化处理的菌体混合液经过Miracloth过滤后,就可以去掉未被消化完全的菌体和杂质,分离得到的“裸露的”原生质体就可以准备进行转化或者电转了。如果没有这一步的分离,未完全消化的菌体由于生长迅速,会严重干扰结果。植物基因组纯化相对比较麻烦一点,市面上有不少试剂盒可供选择,多数纯化基因组DNA的试剂盒采用快速离心方法,其纯化产物大小仅为50kb左右。你可能没有想到,一种改良的Miracloth快速纯化方法是另一种经济有效的选择:通过液氮研磨得到
(细菌内同源重组AdEasy System)一、目的基因的克隆(以pshuttle-CMV质粒为例)步骤1、选择适当酶切位点,进行酶切连接,将目的片段插入pshuttl-CMV质粒多克隆位点。2、重组质粒鉴定: 酶切鉴定或测序。3、重组质粒扩增,纯化并准备适量含目的基因的穿梭质粒。4、用PmeI单酶切线性化重组穿梭质粒,电泳鉴定质粒完全被切开。5、胶回收线性化质粒,以备共转化使用。二、共转化 1、大肠杆菌BJ5183电转感受态制备 (1)从新鲜琼脂板上挑取单个BJ5183细菌,接种于LB
 技术资料
技术资料暂无技术资料 索取技术资料









