相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 库存:
50
- 英文名:
Soy Protoplasm Preparation and Transformation Kit
- 供应商:
上海博尔森生物科技有限公司
- 保存条件:
RT&-20℃
- 规格:
5T
大豆原生质体制备及转化试剂盒(20mL/T)
储存条件:A盒,-20 ℃储存;B盒,常温储存。
产品组成
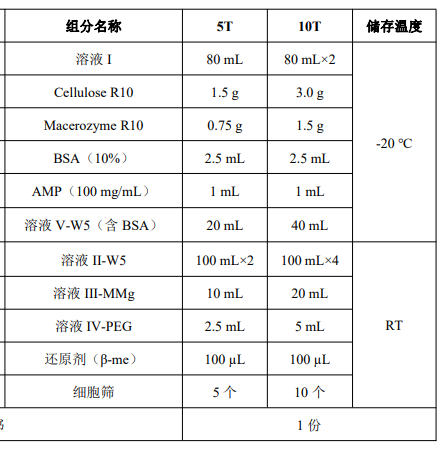
产品简介:
本试剂盒主要通过纤维素酶和离析酶配制的酶解液消化植物细胞壁获得原生质体。适用于从短日照培 养或者生长在培养皿内的番茄幼苗叶片中分离原生质体。获得的细胞可用于蛋白的亚细胞定位,验证蛋白 间的相互作用,研究蛋白的转录调控等。
本试剂盒包含原生质体制备和转化所需的全部试剂,照每次 20 mL 酶解液的使用量,可供 5 次(5T)/10 次(10T)实验。
使用说明:
一、准备工作
1. 需要准备的材料(本试剂盒不提供):
锋利刀片;血球计数板;50 mL 离心管;2 mL 离心管。
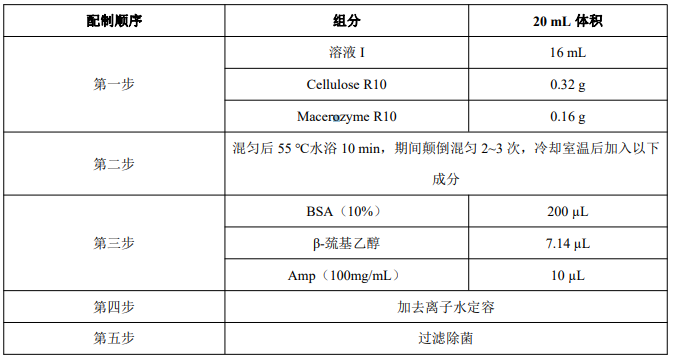
2. 即用型酶解液配制
二、原生质体的分离制备
1. . 在 28 ℃的黑暗环境中培养 7~12 天大豆黄化苗,至大豆幼苗第一片真叶完全展开。以真叶完全展开后 4天的大豆的叶片作为大豆原生质体细胞制备的材料。
2. 将 1 g 新鲜的大豆组织材料(样品量可适当增加)用锋利的刀片将材料切成大小约 0.5 mm 宽的细条。置于含有 20 mL 酶解液的三角瓶内,于黑暗条件下 100 rmp/min,28 ℃震荡酶解 10 h。
3. 酶解后的产物用细胞筛过滤,用镊子或无菌枪头轻轻搅拌,充分释放原生质体,去除未消化的叶片组织。用 10 mL 预冷的溶液 II-W5 solution 冲洗酶解器皿和未消化的叶片 2~3 次,将所有的液体收集到 50 mL 离心管中。
注:操作过程中动作尽可能轻柔,避免剧烈震荡,防止原生质体破碎。
4. 选用水平转头,室温 150 g 离心 2 min,升速 3,降速 3,去除上清。
注:去除液体时最好用移液枪,避免直接倒。离心时,可调低离心机的升速和降速。升速过快,原生质体可能离到管壁上;降速过快,可能导致管底原生质体悬起。建议升速和降速分别都使用 3。
5. 加入 10 mL 预冷的溶液 II-W5 solution,用蓝枪头(剪掉尖端)轻轻悬起原生质体,100 g 离心 10 min,升速 3,降速 3,去上清。
6. 加入 1 mL 预冷的溶液 II-W5 solution,用蓝枪头(剪掉尖端)轻轻悬起原生质体,转移至 2 mL 圆底离心管,冰上静置 30 min。
7. 显微镜下观察原生质体状态并计数。
注:原生质体呈现圆球形(大小约 30~40 μm),叶绿体分散在整个细胞内,说明状态较好;如呈现不规则形状,说明原生质体破碎或即将破碎。如果细胞量较少(少于 2× 2×105个/mL),可以将所有细胞用于 1~2个转化体系。
7. 室温 150 g 离心 2 min,升速 3,降速 3,去上清。加入适量溶液 III-MMg 溶液重悬原生质体,调整浓度为 2×105个/mL。
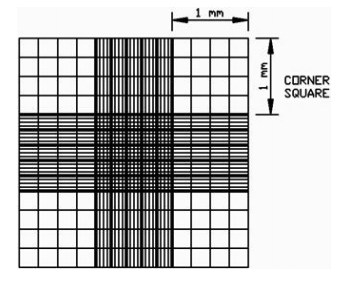
血球计数板的使用:
如下图所示,在血球计数板上加上一个盖玻片,分别从两侧凹槽加入样品。使用中央区域长和宽都是 1 mm 的方形区域进行计数(25 个中方格)。分别统计正方形四个顶角和中央的小正方形的细胞数量,取 平均值再乘以 25(正方形被分成了 25 个小正方形),计算该区域的细胞数量,该区域的体积为 0.1 µL(长 1 mm,宽 1 mm,高 0.1 mm)。计算获得的细胞数量。原生质体浓度(个/mL)=25 个中方格原生质体数 ×104×稀释倍数。
三、原生质体的转化
1. 在 2 mL 的圆底离心管中加入 20 µL(10~20 µg)纯化后的质粒,随后加入 200 µL 已调整好浓度的原生质体,轻轻混匀,再加入 220 µL 的溶液 IV-PEG solution,轻柔旋转离心管,使用蓝枪头(尖端剪掉)轻轻吸打,直至混匀,此过程应避免产生气泡,28 ℃弱光培养 20 min,每 5 min 轻柔混匀。
2. 加入 0.5 mL 的溶液 II-W5 solution,轻柔混匀,终止转化。常温 100 g 离心 10 min,升速 3,降速 3,在不损失原生质体的情况下,尽可能去上清。
3. 加入 1 mL 的溶液 II-W5 solution 悬浮原生质体,常温 100 g 离心 10 min,升速 3,降速 3,去上清。
四、原生质体的培养和收集
1. 加入 1 mL 的溶液 V-W5(含 BSA)培养液悬浮细胞。将离心管水平放置将离心管水平放置,28 ℃弱光培养 16 h。
2. 收集细胞时,缓慢将离心管拿起,用枪头将附着在管壁上的细胞轻轻悬起,离心管室温垂直静置几分钟后再离心,100 g 离心 10 min,升速 3,降速 3,去除大部分溶液 V-W5(含 BSA),收集原生质体,用于后续实验。
注意事项:
1. 分离制备的原生质体没有细胞壁的保护,非常脆弱,整个实验操作过程中动作尽可能的轻柔。
2. 为了避免原生质体离心时贴在管壁,建议整个实验过程使用平角转头。
3. 实验过程中尽可能使用剪尖蓝枪头(1 mL 吸头),因为其尖端的孔径较大;或把黄色枪头的尖端剪掉,保证平滑。
特别提示:本公司的所有产品仅可用于科研实验,严禁用于临床医疗及其他非科研用途!
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验大豆β-伴球蛋白(β-conglycinin)酶联免疫分析(ELISA)
大豆β- 伴球蛋白( β-conglycinin) 酶联免疫分析( ELISA ) 试剂盒使用说明书 本试剂仅供研究使用 目的:本试剂盒用于测定植物组织,细胞及其它相关样本中β- 伴球蛋白( β-conglycinin) 含量。 实验原理: 本试剂盒应用双抗体夹心法测定标本中大豆β - 伴球蛋白 ( β -conglycinin) 水平。用纯化的大豆β - 伴球蛋白 ( β
一. 植物遗传转化的方法 植物遗传转化技术可分为两大类:一类是直接基因转移技术,包括基因枪法、原生质体法、脂质体法、花粉管通道法、电激转化法、PEG介导转化方法等,其中基因枪转化法是代表。另一类是生物介导的转化方法,主要有农杆菌介导和病毒介导两种转化方法,其中农杆菌介导的转化方法操作简便、成本低、转化率高,广泛应用于双子叶植物的遗传转化。二.农杆菌介导的基因转化方法 (一)农杆菌的Ti质粒与T-DNA 的整合机制几乎所有双子叶植物都容易受到土壤农杆菌感染,而产生根瘤。它是一种革兰氏阴性土壤杆菌
安排】 第一天下午:配制6×电泳加样缓冲液、TAE等缓冲液,将各种耗材灭菌。 第二天上午:制备琼脂糖凝(1%),电泳检测,切胶回收DNA片段 第二天下午:大肠杆菌制备感受态细胞;DNA与T载体连接转化大肠杆菌。 第三天上午:观察转化结果(蓝白斑情况),计算重组率。 【实验报告要求与思考
 技术资料
技术资料暂无技术资料 索取技术资料










