上海昂朴生物科技有限公司
2 年
手机商铺
- NaN
- 0.7999999999999998
- 1.7999999999999998
- 0.7999999999999998
- 3.8
推荐产品
公司新闻/正文
Nature | 突破!iPSC模型揭秘ALS/FTLD致病新机制,NPTX2成治疗新靶点
6968 人阅读发布时间:2025-06-24 16:09




TDP-43蛋白的异常聚集是肌萎缩侧索硬化症(ALS)和额颞叶变性(FTLD)的核心病理特征,其核功能丧失导致RNA代谢紊乱,但动物模型因物种差异无法模拟人类特异性机制,而传统iPSC分化的神经元因成熟度不足难以再现长期病理进程。本研究通过优化iPSC技术,构建了长期稳定的神经网络模型(iNets),旨在解析TDP-43病理的人类特异性机制及其下游效应分子。iNets模型的建立突破了以往体外系统成熟度不足的瓶颈,为研究神经退行性疾病的动态病理过程提供了新工具。这一突破性模型不仅填补了人类TDP-43病理体外研究的空白,还为探索其他神经退行性疾病的分子机制提供了通用平台。

研究团队从人皮肤成纤维细胞重编程获得iPSC,通过手动筛选神经前体细胞建立了均一的神经干细胞系iCoMoNSCs,其单细胞转录组显示约79%为自我更新的神经干细胞。分化后的iCoMoNSCs形成包含神经元和胶质细胞的iNets模型,经长期培养(7个月)后通过高密度微电极阵列(HD-MEA)记录到成熟的功能性神经网络活动(图1)。为模拟TDP-43病理,研究采用慢病毒稀疏感染技术,在iNets中过表达野生型TDP-43(图3),结合单细胞转录组测序、生化富集(SarkoSpin)及患者脑组织免疫荧光分析,系统揭示了TDP-43对突触蛋白NPTX2的调控机制。实验还通过荧光素酶报告系统验证了TDP-43与NPTX2 3'UTR的直接结合(图4),并利用CRISPRi筛选鉴定出调控Tau传播的关键修饰因子,如VPS29和UFMylation通路基因。
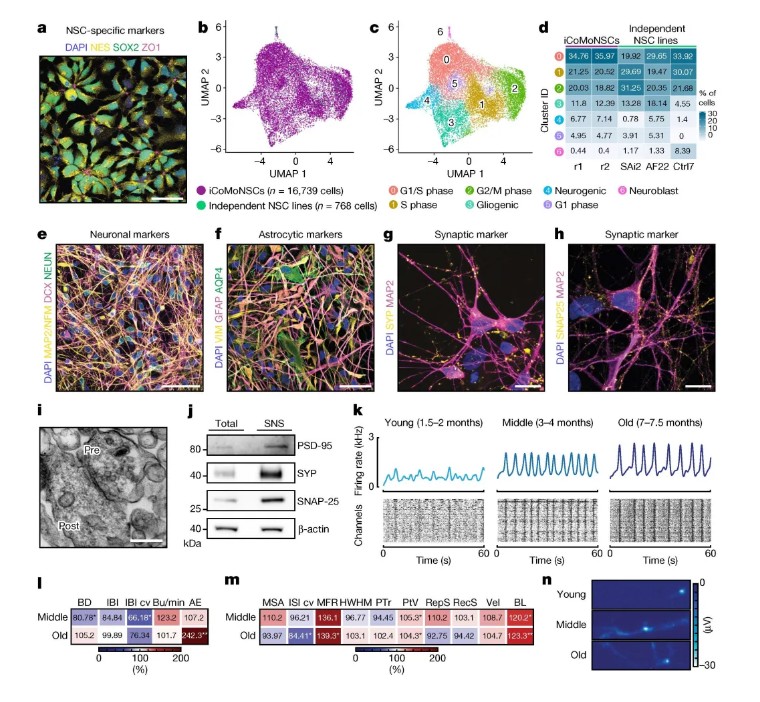
图1 iCoMoNSCs的构建及iNets的电生理特性
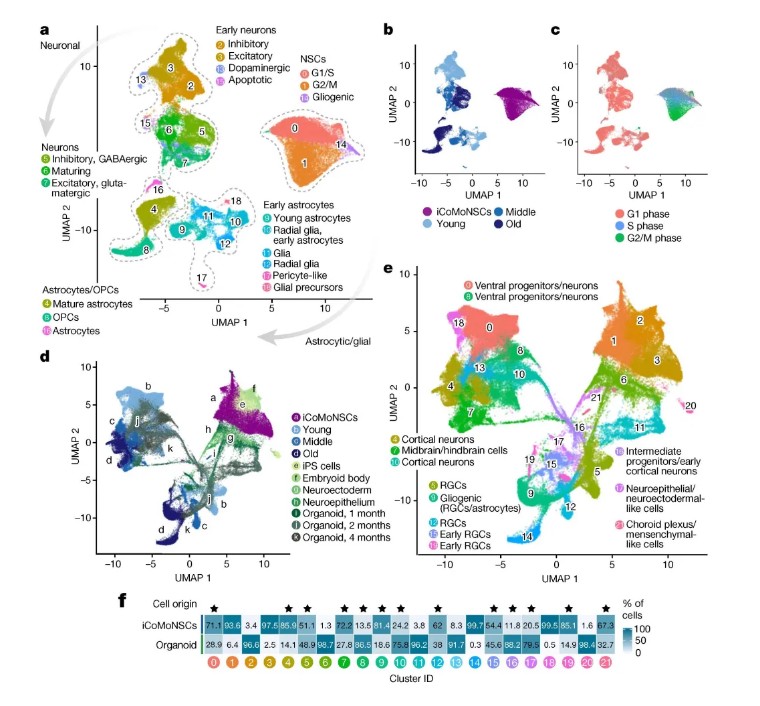
图2 iNets单细胞转录组分析

iNets模型在长期培养中表现出稳定的突触连接和电生理活性,电镜显示突触小泡及突触后致密区结构(图1),单细胞转录组分析进一步证实其神经元与皮质类器官的成熟度相当(图2)。在TDP-43过表达的神经元中,TDP-43逐渐形成不溶性聚集体和C末端片段,并通过磷酸化修饰(pS403/404)扩散至周围非转基因神经元。单细胞测序发现,过表达TDP-43的神经元中突触蛋白NPTX2的mRNA显著上调(图3),其3'UTR直接受TDP-43结合调控。小鼠Nptx2因3'UTR序列差异缺乏此调控,提示NPTX2异常为人类特异性机制。临床样本验证显示,ALS和FTLD-TDP患者脑组织中NPTX2在TDP-43阳性神经元内异常累积(图4),而其他蛋白病(如FUS或tau病变)中未见此现象。功能实验进一步证实,NPTX2过表达直接引发神经元死亡,而shRNA敲低可部分挽救TDP-43毒性(图5)。
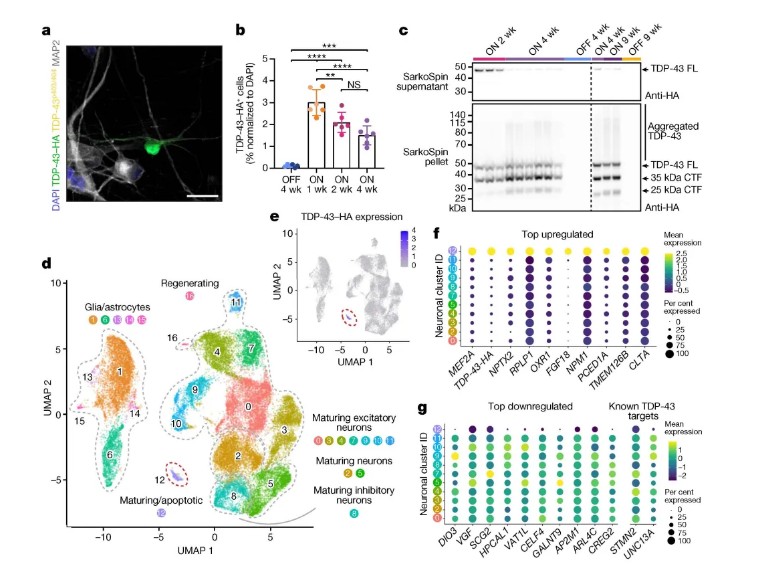
图3 TDP-43过表达诱导病理变化及NPTX2上调
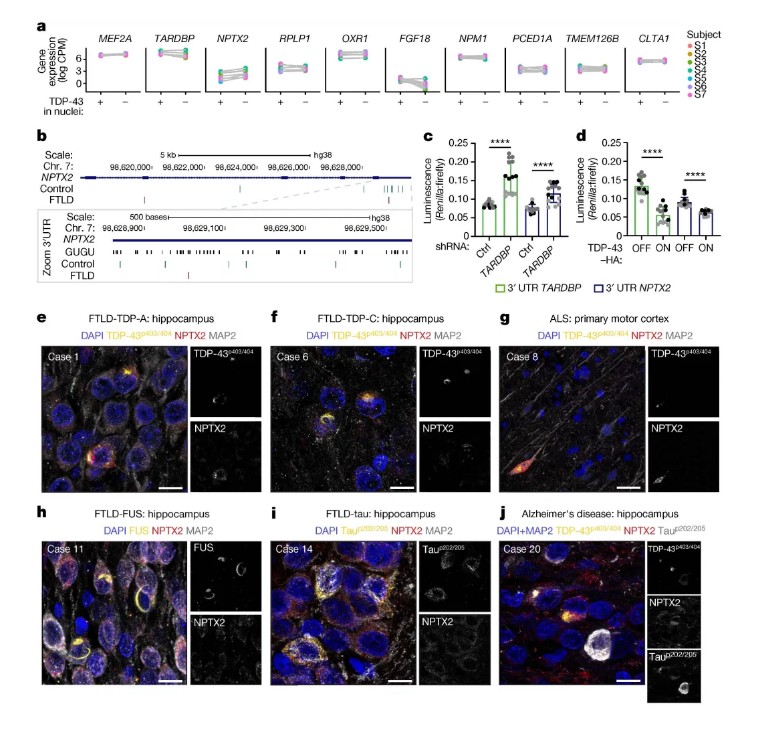
图4 NPTX2在患者脑组织中的异常积累
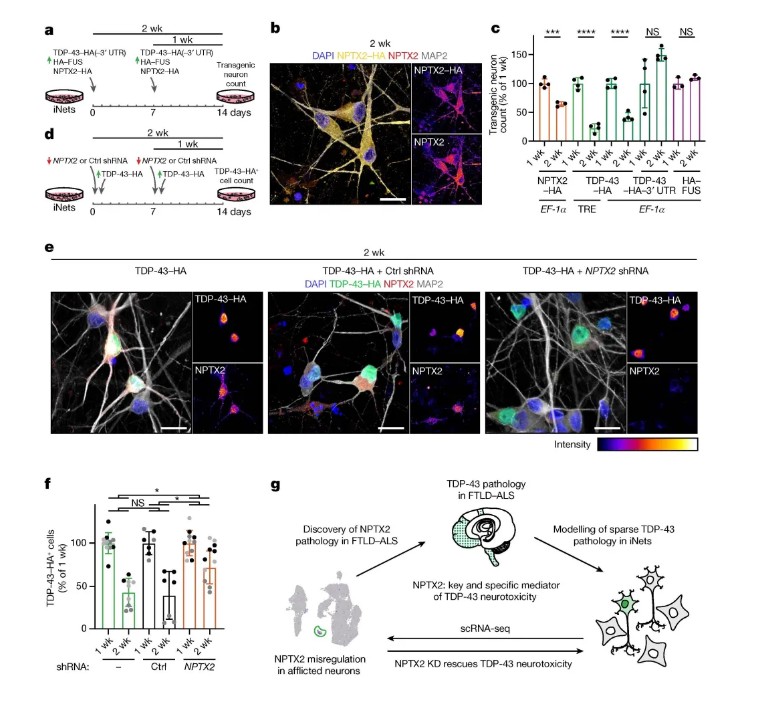
图5 NPTX2的神经毒性验证及干预策略

本研究通过iPSC技术构建的iNets模型,首次在体外重现了TDP-43蛋白病变的长期动态病理过程,揭示了NPTX2作为TDP-43下游效应分子的核心作用。NPTX2的异常积累通过突触兴奋性毒性驱动神经退化,其人类特异性调控机制为靶向治疗提供了新方向。该模型不仅填补了人类TDP-43病理研究的空白,还为解析其他神经退行性疾病的分子机制提供了可扩展的平台。未来研究可基于此平台筛选小分子抑制剂或基因编辑工具,探索NPTX2与STMN2/UNC13A等靶点的协同干预策略,推动ALS/FTLD的精准治疗。