粒曼生物科技(武汉)有限公司
3 年
手机商铺
- NaN
- 0
- 0
- 0
- 0
推荐产品
技术资料/正文
问题解读 I 为什么WB实验不完全适用于KO细胞的敲除效率评估(2)
789 人阅读发布时间:2024-09-12 19:54
Western Blot(免疫印迹,WB)实验,很多研究人员将它作为基因敲除细胞系构建成功与否的评价标准,在很多科学论文中我们也可以发现,WB数据是验证基因敲除细胞材料合格的关键证据。但WB实验结果与基因敲除实验成功与否之间是否存在充分必要条件,通过该文章希望可以清晰的理顺其两者的逻辑关系:“为什么WB不完全适用于KO细胞的敲除效率评估”。
关于实验原理等问题的解析,请阅读:问题解读:为什么WB实验不完全适用于KO细胞的敲除效率评估(1)
三、为什么WB不完全适用于KO效率评估
接下来,我们详细展开几种情况,说明WB为什么不完全适用于KO效率评估,如果您对KO细胞的裂解液进行WB实验得到的结果是有条带,但是基因水平上证明发生了基因片段丢失或移码突变,将如何合理地判断是否KO成功。
1. 蛋白质半衰期问题:蛋白质半衰期指的是蛋白质量减少到其原始量一半所需的时间。不同的蛋白质有不同的半衰期,从几分钟到几天甚至更长都有可能。
如果目标蛋白的半衰期很长,即使通过基因编辑技术成功地在DNA水平上实现了基因敲除,细胞内现存的蛋白质仍然可以在一定时间内维持其水平。这意味着WB可能会检测到这些尚未降解的蛋白质,从而导致对KO效率的高估。此外,如果KO操作后没有足够的时间让蛋白质降解,那么即使敲除效率很高,WB也可能显示出较高的蛋白水平。这就是为什么在评估KO效率时,仅仅依靠WB可能会得到不准确的结果。为了克服这个问题,通常需要等待足够长的时间以让大部分现存的目标蛋白降解后再进行WB分析,或者结合其他方法如PCR/qPCR来评估基因表达水平的改变,以及使用次代测序(NGS)等技术来直接分析基因组层面上的编辑效果。即使基因被成功敲除,由于蛋白质的稳定性,蛋白质可能在细胞内停留一段时间,WB检测到的蛋白水平可能不能立即反映出敲除效果。
2. 非特异性结合问题:非特异性结合是抗体与目标蛋白以外的其他蛋白质或分子发生错误结合,这可能导致误导性的信号。产生非特异性结合的原因:
2.1 抗体特异性不足:如果所用的抗体对目标蛋白的识别不够特异,它可能会与具有类似表位的其他蛋白质结合。这种情况下,WB的结果可能包含了与非目标蛋白相互作用的信号,从而干扰了对敲除效果的准确评估。
2.2 交叉反应:即使抗体相对特异,也可能存在与其他蛋白发生交叉反应的可能性,尤其是在高度同源的蛋白家族中。
2.3 检测限:WB的检测限也可能导致非特异性信号的出现。例如,过度曝光的膜可能显示出背景中的非特异性带。
2.4 样品处理和加载:样品准备过程中的污染或者加载时的交叉污染也可能引起非特异性信号。
2.5 阻断步骤不充分:在WB过程中,通常使用牛血清白蛋白(BSA)或脱脂奶粉等来阻断膜上未被蛋白质占据的部位,以减少非特异性结合。如果阻断步骤不充分,剩余的可结合位点可能会与抗体产生非特异性结合。
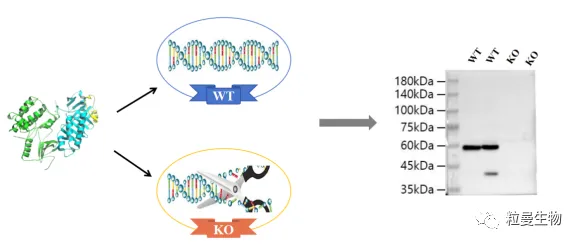
图1 抗体KO验证流程简图
——针对抗体特异性问题,粒曼团队与国内一线科研抗体公司建立长期战略合作,全面推进抗体KO验证(期待下期:问题解读 I 为什么KO验证成为抗体特异性验证的金标准 ),推荐科研工作者选择被KO验证过的抗体用于WB等相关实验,欢迎登陆粒曼官网进行查询!
3. 蛋白质表达水平与基因副本数关系不直接问题:基因敲除可能只影响部分基因副本(例如有的肿瘤细胞系,存在十几个甚至几十个基因组copy数),导致蛋白水平下降但不完全消失,而WB难以区分部分敲除和完全敲除。
3.1 补偿性表达:有时细胞会通过提高剩余正常基因副本的表达来补偿被敲除基因的丧失,这可能导致WB检测到的蛋白质水平与基因副本数不成比例。
3.2 异源表达:在多基因家族中,敲除某个基因可能导致其他同源基因的表达水平改变,作为一种补偿机制。这种情况下,WB可能检测到其他同源蛋白的表达增加,而不是仅仅反映被敲除基因的蛋白产品。
3.3 抗体特异性:如果所使用的抗体不能区分被敲除的基因产物和其他同源蛋白,那么WB可能会检测到非特异性信号,从而无法准确反映特定基因副本数的变化。
3.4 mRNA和蛋白质半衰期差异:基因副本数的变化首先影响的是mRNA的水平,但mRNA和蛋白质的半衰期可能大不相同。一个长半衰期的蛋白质即使在mRNA水平下降后也可能在细胞内保持较长时间,这会影响WB的结果。
3.5 非线性关系:基因表达是一个复杂的过程,蛋白质水平不一定与基因副本数有直接的线性关系。例如,一些基因可能存在剂量效应,而其他基因则可能在达到一定阈值前不表现出明显的表达差异。
因此,当使用WB来评估KO效率时,需要结合其他技术,如实时定量PCR(qPCR)来检测mRNA水平,或者使用Southern blot来直接评估基因副本数的变化,可以提供更全面的信息。这样,可以从不同层面综合评估基因敲除的效果,而不是仅依赖于WB的结果。4. 截断蛋白问题:在基因敲除实验中,有时基因编辑并不会完全消除目标蛋白,而是产生一个缺失部分序列的截断蛋白(truncated protein)。
4.1 抗体识别位点:如果WB使用的抗体是针对目标蛋白的C端(羧基端)设计的,而基因敲除导致的截断蛋白丢失了C端,那么即使截断蛋白(除C端以外的区域)存在,WB也检测不到。相反,如果抗体识别的是N端(氨基端),那么即使产生了截断蛋白,WB依然会显示出信号,从而无法准确反映完整蛋白的丢失。
4.2 蛋白大小变化:截断蛋白可能比完整蛋白小得多,导致在凝胶电泳中迁移速度不同,从而在WB的膜上表现为不同的条带位置。如果实验者没有意识到这一点,可能会错误地认为KO效率很高,而实际上只是检测到了截断蛋白而非完整蛋白。
图2 WB检测截断蛋白简图
4.3 蛋白稳定性变化:截断蛋白的稳定性可能与完整蛋白不同,这可能导致其在细胞内的半衰期改变。如果截断蛋白更不稳定,它可能会被更快地降解,这样WB检测到的信号会减弱,即使截断蛋白的生成效率并未降低。
4.4 功能性变化:截断蛋白可能丧失了原始蛋白的一些或全部功能。如果WB用于评估KO的功能效果,仅仅检测到截断蛋白,并不能说明其是否保持了原来蛋白的生物学活性。
4.5 表达水平的误判:由于截断蛋白可能具有不同的表达水平和稳定性,WB所反映的量不能准确地代表蛋白的真实生物学状态。
5. 转录后调控问题:蛋白质表达受到多层次的调控,其中包括转录后修饰、mRNA稳定性、翻译效率和蛋白质稳定性等因素。即使基因副本数减少,这些转录后机制仍可能调节蛋白质的最终表达水平。5.1 转录后修饰:在mRNA合成完成后,mRNA分子可能会经历一系列的修饰,如5'帽结构添加、3'聚腺苷酸尾巴添加、剪接等。这些修饰可以影响mRNA的稳定性、转运、翻译效率和蛋白质产量。5.2 mRNA稳定性:mRNA的寿命可以受到多种因素的调节,包括RNA降解酶的作用、RNA结构、RNA结合蛋白的调控等。稳定的mRNA会更长时间地存在于细胞内,从而增加蛋白质表达的机会。5.3 翻译效率:翻译是将mRNA转化为蛋白质的过程,在此过程中可以发生多种调控。一些因素如启动子序列、翻译起始位点、转运RNA可变剪接等,可能影响翻译复合物的组装和翻译的效率。5.4 蛋白质稳定性:蛋白质在细胞内的寿命也可以受到调控。某些蛋白质可能具有不同的稳定性,受到泛素化、蛋白酶降解等机制的影响。 总之,WB在检测蛋白质水平方面有其局限性,因此在评估基因敲除效率时,需要结合DNA层面的分析(如PCR、qPCR、NGS)和蛋白质功能的验证(如酶活性测试、细胞功能实验)来综合评价。可通过其他方法结合验证KO细胞敲除效率的评估,如:使用多个不同表位位点的抗体进行WB(确保能够检测到截断蛋白),通过质谱(Mass Spectrometry, MS)分析(鉴定蛋白质的确切大小和序列),利用实时定量PCR(qPCR)来检测mRNA水平(间接推断蛋白表达),进行功能性实验(评估蛋白质的生物学活性是否受到影响)。
——基于综合性评估和大量基因敲除案例回顾,粒曼团队采用独家sgRNA的设计思路,使用PCR+Sanger测序技术可准确评估DNA水平的敲除效果,以及基于高通量蛋白质组学技术在蛋白质及多肽水平的广泛深度覆盖优势,“粒曼验证方案”成为基因敲除效率评估的最佳实践,并作为行业标准起草单位得到学术界和工业界的认同。
粒曼团队提供的基因敲除细胞系(单克隆)产品及服务,提供纯合子KO细胞系,并选择基因大片段丢失+移码突变(非3的倍数)同时发生的单克隆细胞作为内部质控标准,避免产生上述“截断蛋白问题”以及“转录后调控问题”等。