粒曼生物科技(武汉)有限公司
3 年
手机商铺
- NaN
- 0
- 0
- 0
- 0
推荐产品
技术资料/正文
问题解读 I 为什么WB实验不完全适用于KO细胞的敲除效率评估(1)
294 人阅读发布时间:2024-09-12 19:44
Western Blot(免疫印迹,WB)实验,很多研究人员将它作为基因敲除细胞系构建成功与否的评价标准,在很多科学论文中我们也可以发现,WB数据是验证基因敲除细胞材料合格的关键证据。但WB实验结果与基因敲除实验成功与否之间是否存在充分必要条件,通过该文章希望可以清晰的理顺其两者的逻辑关系:“为什么WB不完全适用于KO细胞的敲除效率评估”。
一、Western Blot 技术原理
免疫印迹实验是根据抗原抗体的特异性结合检测复杂样品中的某种蛋白的方法。该法是在凝胶电泳和固相免疫测定技术基础上发展起来的一种新的免疫生化技术,就是将蛋白质转移到膜上,然后利用抗体进行检测的方法。
对已知表达蛋白,可用相应抗体作为一抗进行检测,与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,探针是抗体,显色用标记的二抗。经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。该技术也广泛应用于检测蛋白水平的表达。
Western Blot实验的原理本质是抗原抗体反应,更加微观的来说,是抗体的可变区与抗原的一段序列进行结合,该段序列称为抗原表位Epitope(更加明确的说,称为线性表位,本文章不讨论空间表位的情况,即抗体是基于抗原的特异性空间结构来识别)。当抗体与抗原蛋白质结合时,它不与整个全长蛋白质结合,而是与被称为表位的蛋白区域结合,通常该区域长度约为5或6个氨基酸。典型的全长蛋白质序列实际上含有许多不同的表位,抗体可以与之结合(如图1)。通俗的说,如果样本(例如细胞的裂解蛋白溶液)中存在某抗原的表位多肽,针对该表位的单克隆抗体就可以与之结合,相应的WB实验就可以显色。
WB实验的关键是抗体的质量,目前单克隆抗体已经逐渐替代多克隆抗体,成为WB实验中使用越来越多的抗体类型。而高质量的单克隆抗体是有明确的抗原表位。但是,我们在制备单克隆抗体和质量控制环节中,很少会将抗原表位信息获得(有相关的技术可以检测到,但往往投入比较大,欢迎咨询粒曼团队)。因此,在目前科研抗体的国内外供应商中,极少的抗体公司在产品说明书中会提供抗原表位信息。该现实情况是我们科研工作者往往忽视的一个关键信息。
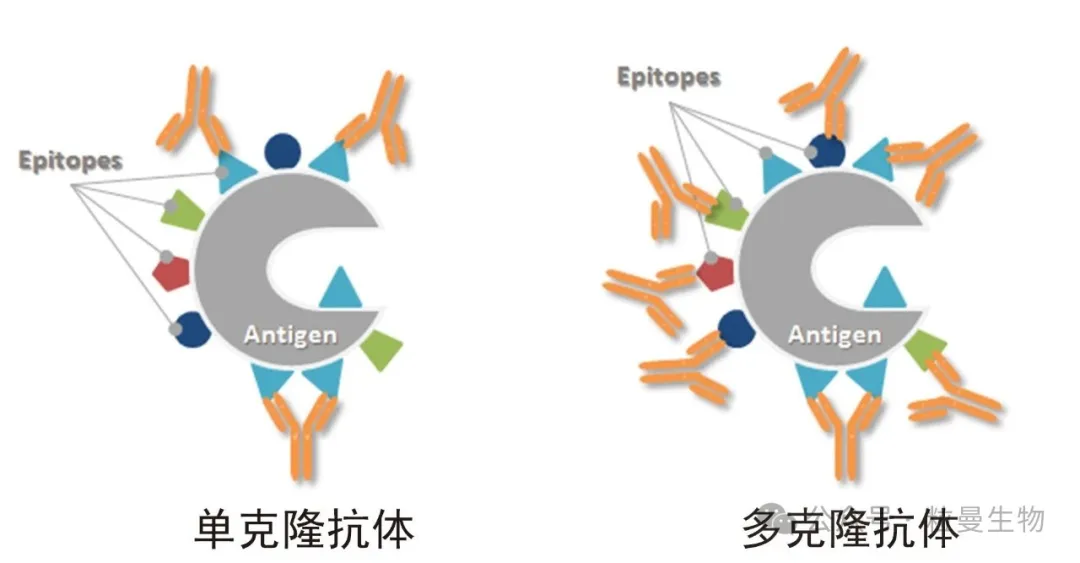
图1 抗原表位图示
二、基因敲除效率评估方法
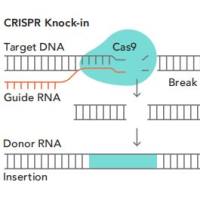
提到基因敲除效率评估前,首先需要对“基因敲除”的定义进行明确。按照Wikipedia 定义,基因敲除(英语:gene knock-out,缩写KO)是一种遗传工程技术,是指利用外源的已突变的基因通过同源重组的方法替换掉内源的正常同源基因,从而使内源基因失活而表现突变体的性状的技术或方法。结合基因敲除过程来说,进行基因编辑时,核酸内切酶(例如Cas9)能够识别并切断靶DNA序列,产生DNA双链断裂(Double-strand break,DSB),细胞会进行及时修复,主要有两种修复途径:非同源末端连接(Non-homologous end joining, NHEJ)和同源重组(Homologous directed repair, HDR)。通过NHEJ修复DSB时,细胞常会在断裂位点插入或删除几个碱基(indel),快速将DNA连接起来,因此导致的基因序列变化而使修复后的基因突变,功能丧失,称之为基因敲除。简单说,基因敲除就是靶基因的功能丧失。而导致基因失活的方式,也是基因敲除实现的两种形式:片段丢失和移码突变。
以下几种技术手段可以用来鉴定片段丢失和移码突变:
1.DNA水平检测:基因敲除后,目标基因的DNA序列应该发生片段丢失或移码突变,可以通过PCR或者定量PCR等方法来检测,通常可以比较敲除细胞与野生型细胞的基因组DNA序列来实现。如果目标基因的特定DNA片段无法被扩增出来,或者扩增出来的片段长度与野生型细胞不同,就说明基因敲除可能已经发生。当然PCR引物的设计需要基于sgRNA的设计来合理安排验证方案。
2.RNA水平检测:基因敲除会导致目标基因的mRNA无法正常转录或稳定存在,因此,与野生型细胞相比,敲除细胞中目标基因的mRNA水平应该明显降低或无法检测到,可以通过RT-PCR等方法来检测,具体参考“问题解读I 为什么qPCR不完全适用于KO细胞的敲除效率评价?”
3.蛋白质水平检测:基因敲除会导致目标基因产物(蛋白质)的水平显著降低或消失。这可以通过Western Blot、蛋白质组学等方法来检测。需要指出的是,WB是基于抗体的抗原表位来检测的,无法反映目标蛋白整个序列的表达情况。基于质谱技术的高通量蛋白质组学可全面反馈细胞内蛋白的表达水平及覆盖情况。通过蛋白质组学前处理可将目标蛋白酶解成多肽,利用高分辨质谱仪(LC-MS/MS)通过检测多肽来尽可能地覆盖目标蛋白的表达情况(多肽覆盖率数据分析),从而突破了WB实验基于5-6个氨基酸的抗原表位的限制。
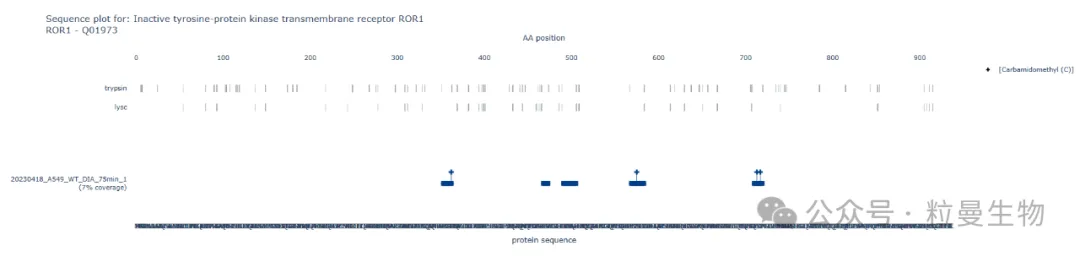
图2 蛋白质组学鉴定的WT细胞及KO细胞的多肽覆盖情况
4.细胞功能检测:如果目标基因在细胞中具有重要功能,其敲除可能会导致细胞形态、增殖、分化或代谢等方面的变化。通过观察敲除细胞的表型变化来评估基因敲除效果。细胞功能检测,是最直接的证据证明KO是否成功。然而,在科研中,往往在探寻基因的功能的情况下,通过基因敲除后观察细胞形态、增殖、分化或代谢等方面的变化而推测该基因的功能。这就更加让研究者重视上述DNA水平、RNA水平和蛋白质水平检测的必要性和重要性了。
——基于综合性评估和大量基因敲除案例回顾,粒曼团队采用独家sgRNA的设计思路,使用PCR+Sanger测序技术可准确评估DNA水平的敲除效果,以及基于高通量蛋白质组学技术在蛋白质及多肽水平的广泛深度覆盖优势,“粒曼验证方案”成为基因敲除效率评估的最佳实践,并作为行业标准起草单位得到学术界和工业界的认同。
针对WB不适于KO敲除效率分析的情况,请继续阅读:问题解读 I 为什么WB实验不完全适用于KO细胞的敲除效率评估(2)
粒曼团队提供的基因敲除细胞系(单克隆)产品及服务,提供纯合子KO细胞系,并选择基因大片段丢失+移码突变(非3的倍数)同时发生的单克隆细胞作为内部质控标准,避免产生“截断蛋白问题”以及“转录后调控问题”等。