广州艾迪基因科技有限责任公司
4 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
公司新闻/正文
基因编辑研究聚焦PKM1、PBRM1和S100A9基因敲除
795 人阅读发布时间:2024-09-27 18:15
 因敲除细胞是指利用CRISPR技术进行基因编辑,通过设计特定的sgRNA靶向目标基因的剪切位点,使Cas9蛋白与sgRNA结合并将目的基因从细胞中“剪切”掉,从而实现基因敲除。基因敲除细胞在生命科学、医学和药物研发等领域都有着广泛的应用前景,如利用基因敲除技术建立疾病模型、进行药物筛选和靶点验证、敲除致病基因实现对疾病的基因治疗等。本文选取三篇基因敲除细胞的相关研究为大家进行解读,带您了解这一前沿技术的新进展。
因敲除细胞是指利用CRISPR技术进行基因编辑,通过设计特定的sgRNA靶向目标基因的剪切位点,使Cas9蛋白与sgRNA结合并将目的基因从细胞中“剪切”掉,从而实现基因敲除。基因敲除细胞在生命科学、医学和药物研发等领域都有着广泛的应用前景,如利用基因敲除技术建立疾病模型、进行药物筛选和靶点验证、敲除致病基因实现对疾病的基因治疗等。本文选取三篇基因敲除细胞的相关研究为大家进行解读,带您了解这一前沿技术的新进展。
一、CRISPR/Cas9系统成功敲除PKM1基因,优化CHO细胞系的乳酸生成行为
中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO)是生物制药行业最常用的哺乳动物细胞系之一,用于生产各种治疗性蛋白质,如抗体、激素和其他重组蛋白。丙酮酸激酶(Pyruvate Kinase Muscle,PKM)是一种负责在糖酵解过程中将PEP转变为丙酮酸的酶,丙酮酸可用于细胞能量产生或转化成乳酸。在CHO细胞中,PKM1的表达水平与乳酸生成行为直接相关。研究人员通过CRISPR/Cas9的技术手段敲除PKM1基因可以消除乳酸积累。
在这项研究中,研究人员使用CRISPR/Cas9技术敲除PKM1基因,探究PKM1在CHO细胞系乳酸生成行为中的作用,并验证PKM1水平与乳酸生成之间的直接相关性。结果显示,在敲除了PKM1的细胞系中,没有观察到乳酸积累,即使在利于乳酸积累的培养条件下,乳酸积累也得到了消除,结果表明PKM1的活性是乳酸生成所必需的。通过CRISPR/Cas9系统敲除PKM1基因的细胞系保持了与野生型细胞系相似的生产力和细胞活力,表明PKM1的缺失不会对细胞的生存或生产能力产生负面影响。在工业生产中CHO细胞如果表现出高水平的乳酸生成行为,可能会导致细胞活力和生产力下降,影响生产过程的效率和产品质量。乳酸积累还会引起培养基pH下降,需要添加碱性物质来调节pH,这可能会导致渗透压的增加,进一步影响细胞的生长和蛋白质的生产。通过CRISPR/Cas9等基因编辑技术敲除或抑制PKM1的表达有助于或消除或减少CHO细胞培养过程的乳酸生成,从而提高生产效率和产品质量。
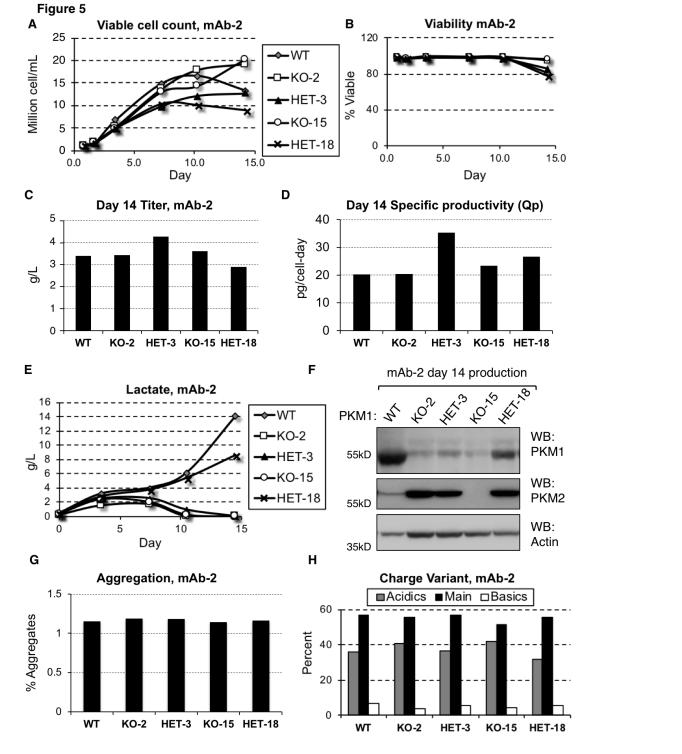 图1 消除或减少PKM 1表达可避免mAb-2细胞系中的乳酸生成行为
图1 消除或减少PKM 1表达可避免mAb-2细胞系中的乳酸生成行为
二、PBRM1基因敲除与ccRCC中较低的免疫原性TME相关
肾细胞癌(Renal cell carcinoma,RCC)是全球十大常见恶性肿瘤之一,最常见的组织学亚型为透明细胞肾细胞癌(clear cell RCC,ccRCC)。ccRCC中存在重要的继发性基因突变,包括PBRM1(polybromo-1)基因。PBRM1是开关/蔗糖非发酵(SWI/SNF)染色质重塑复合体的一部分,约40%的ccRCC存在PBRM1突变。到目前为止,关于PBRM1缺失对免疫反应的影响的数据是不一致的,因此研究人员对于ccRCC中PBRM1缺失对肿瘤微环境(TME)的影响进行了研究。
研究人员通过CRISPR/Cas9基因编辑技术敲除了Pbrm1基因,构建了Pbrm1敲除的Renca小鼠RCC细胞系及其衍生的肿瘤,并采用了Renca-Balb/c免疫小鼠模型进行研究。他们通过免疫组织化学(IHC)染色方法对不同小鼠肿瘤中的免疫标记物进行了评估,包括CD3、CD8、CD4、PD-1和P-STAT1。研究发现,在对照组小鼠的肿瘤中,CD3、CD4、CD8 T细胞和p-STAT1阳性细胞的水平明显高于Pbrm1基因敲除小鼠的肿瘤,同时免疫检查点蛋白PD-1在对照组肿瘤中的表达水平也更高。CRISPR/Cas9基因编辑技术敲除了Pbrm1基因的细胞系构建肿瘤模型证明Pbrm1缺陷与较低的免疫原性肿瘤微环境有关,对肿瘤的免疫治疗具有重要意义。
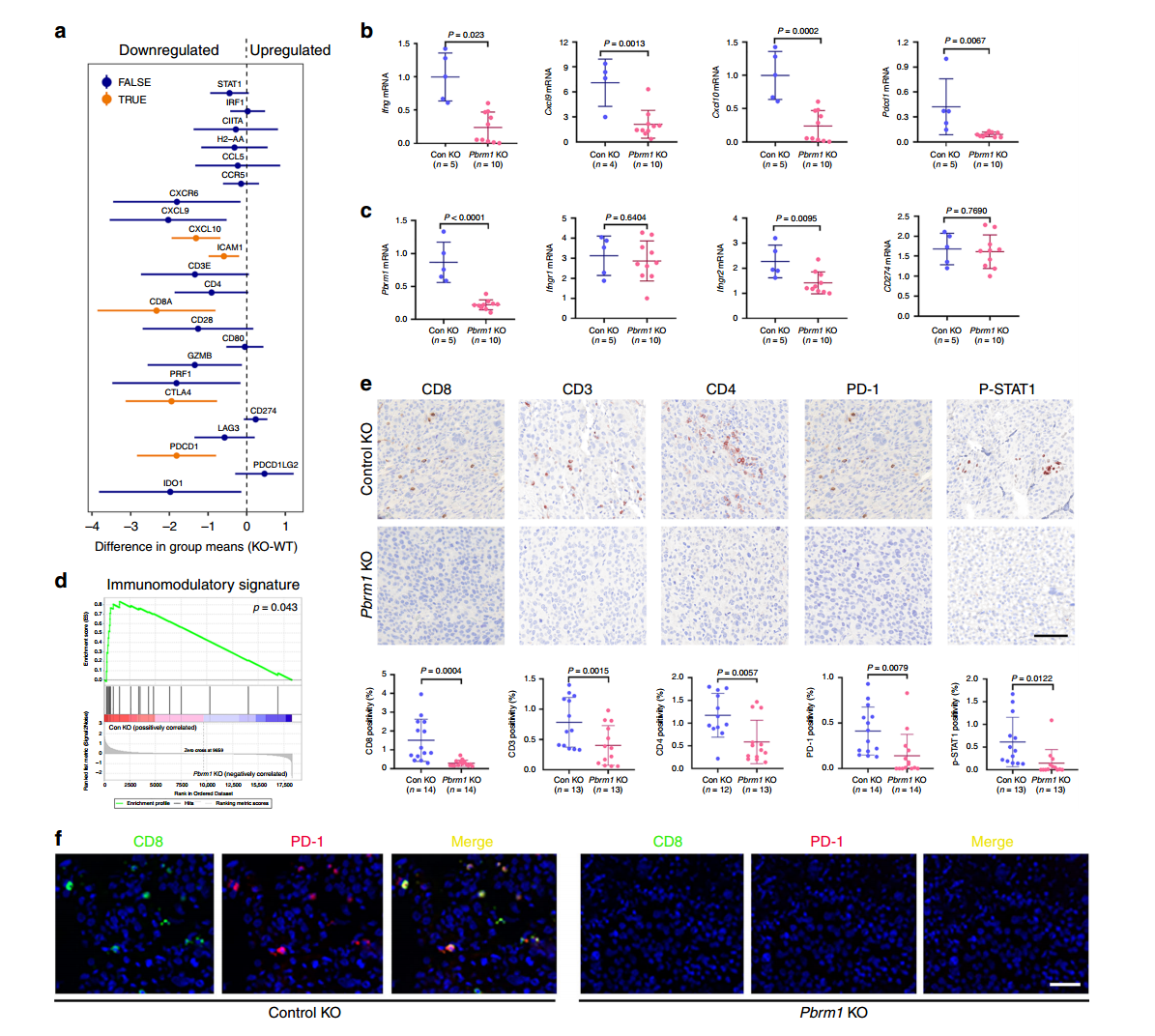 图2 Pbrm1敲除肿瘤与低免疫原性TME相关
图2 Pbrm1敲除肿瘤与低免疫原性TME相关
三、S100A9的敲除为SICM的致病机制的研究提供更进一步探索
败血症性心肌病(Sepsis-induced cardiomyopathy,SICM)是一种常见的由败血症引起的心功能障碍,SICM的病理机制非常复杂,包括几个关键因素,如心肌抑制、线粒体功能障碍、炎症反应和氧化应激。S100钙结合蛋白A9(S100A9)是一种钙和锌结合蛋白,在炎症和免疫反应中发挥着关键的调节作用,但目前对S100A9诱导败血性心力衰竭和心肌损伤的确切机制了解有限。
利用CRISPR-Cas9基因编辑技术,研究人员敲除了小鼠的S100a9基因,并使原代心肌细胞暴露于脂多糖中,模拟了SICM。通过监测炎症标志物和S100A8/9的表达,他们成功地模拟了败血症诱导的心肌病。胸部超声心动图的检查显示,与野生型小鼠相比,S100a9基因敲除小鼠在败血症诱导的心肌病中显示出心肌损伤的缓解。透射电子显微镜的分析显示,野生型对照组的心肌细胞中线粒体嵴密度均匀,而在野生型败血症组中,线粒体的数量和大小异质性显著增加。敲除S100a9基因后,线粒体的损伤有所减轻,并恢复了正常的结构。这些发现揭示了S100A9在败血症诱导的心脏损伤和功能障碍中的作用,并阐明了其诱导氧化应激和线粒体功能障碍的潜在机制。利用CRISPR-Cas9技术敲除S100A9基因的细胞来研究该基因与SCIM间的关联性,提供一种SCIM可能的治疗方案,对SCIM致病机理的研究做出贡献。
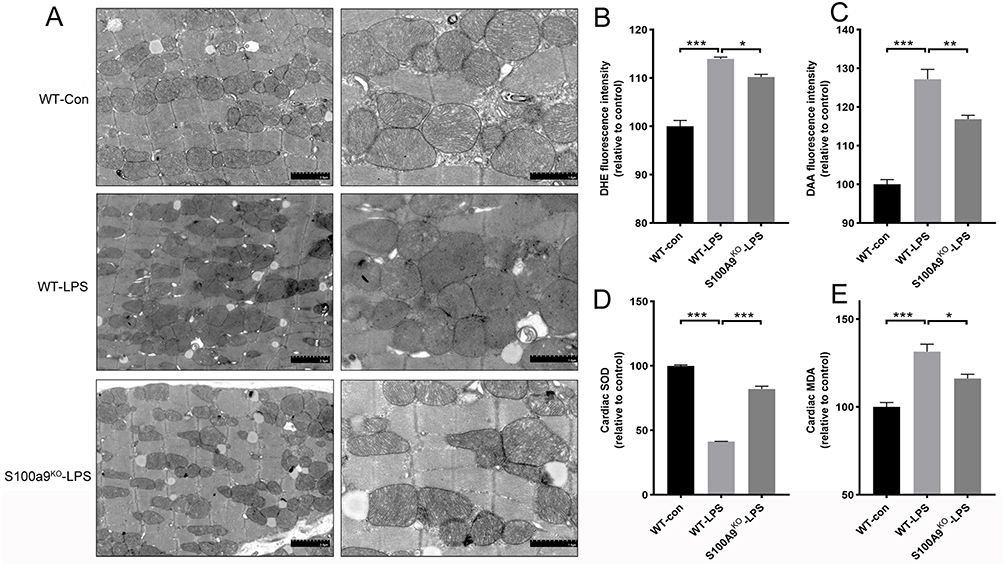 图3 敲除S100a9基因减轻了线粒体损伤和氧化应激
图3 敲除S100a9基因减轻了线粒体损伤和氧化应激