上海富衡生物科技有限公司品牌商
5 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.3999999999999999
- 0.3999999999999999
- 2.4
- 2.4
品牌商
上海富衡生物科技有限公司
入驻年限:5 年
- 联系人:
刘胜富
- 所在地区:
上海 闵行区
- 业务范围:
抗体、ELISA 试剂盒、细胞库 / 细胞培养、论文服务、试剂、实验室仪器 / 设备、技术服务、耗材
- 经营模式:
代理商 经销商 生产厂商 科研机构
推荐产品
技术资料/正文
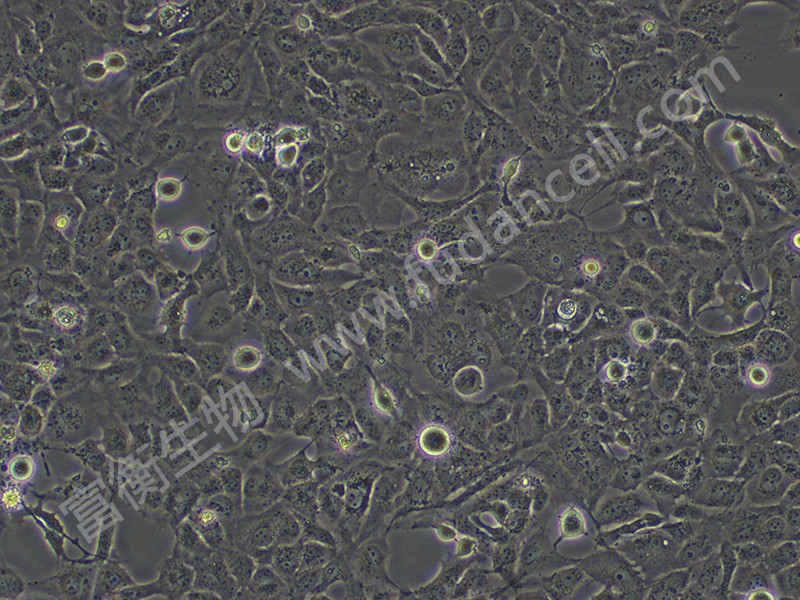
上海富衡 | 人肝星形细胞:LX-2
241 人阅读发布时间:2025-05-11 09:19
LX-2细胞的核心特性与优势
- 人源性:
- 来源于正常人肝星形细胞,相较于大鼠来源的HSC-T6细胞,LX-2更贴近人类肝病病理机制,尤其适用于临床转化研究(如药物靶点验证)。
- 保留部分原代HSCs的遗传背景和信号通路响应(如TGF-β/Smad、NF-κB)。
- 激活状态的可控性:
- 基础状态:LX-2在常规培养中处于“部分激活”状态(低表达α-SMA),但需通过外源刺激(如TGF-β1、脂多糖LPS或高浓度葡萄糖)诱导完全激活。
- 动态模型:可通过撤除血清或添加抑制剂(如SB431542阻断TGF-β受体)模拟激活/逆转过程,研究肝纤维化的可逆性机制。
- 功能兼容性:
- 适用于共培养系统(如与肝细胞系HepG2、巨噬细胞THP-1联用),模拟肝损伤微环境中的细胞互作。
- 支持3D培养(如胶原凝胶或类器官模型),更真实反映细胞外基质(ECM)重塑过程。
培养优化与实验技巧
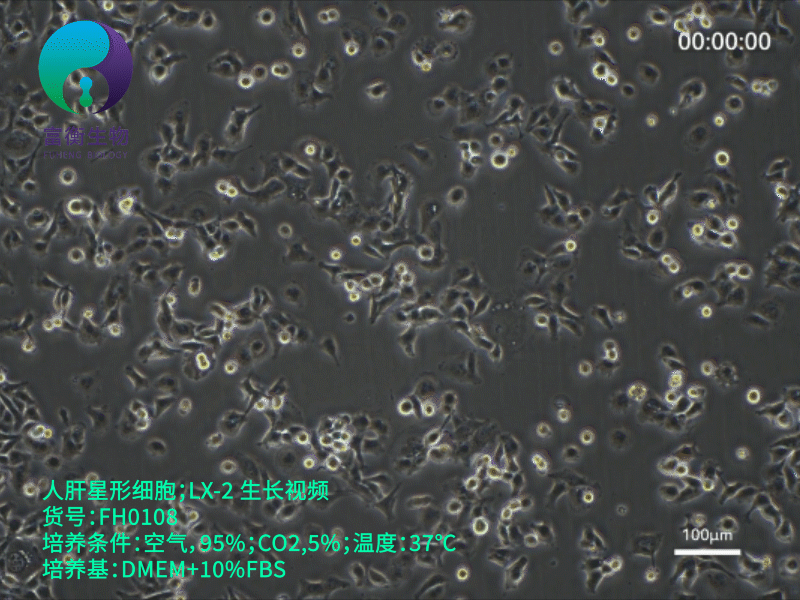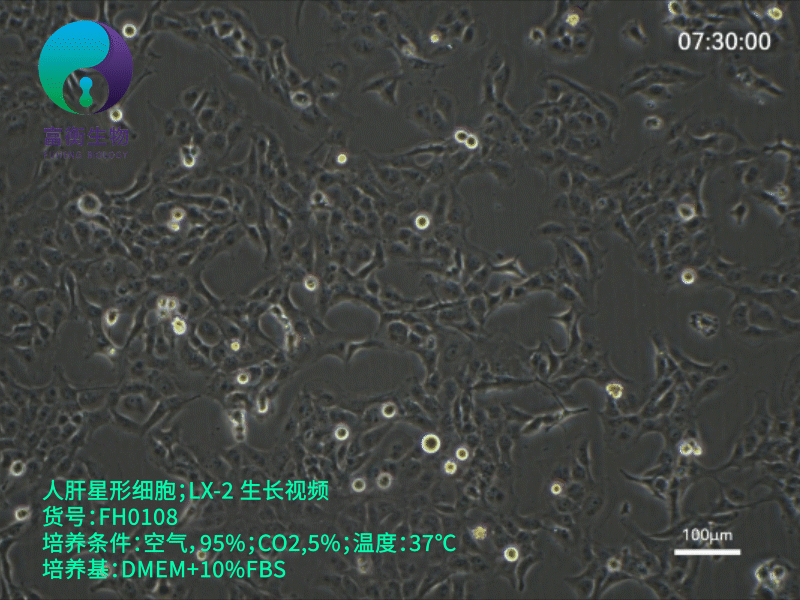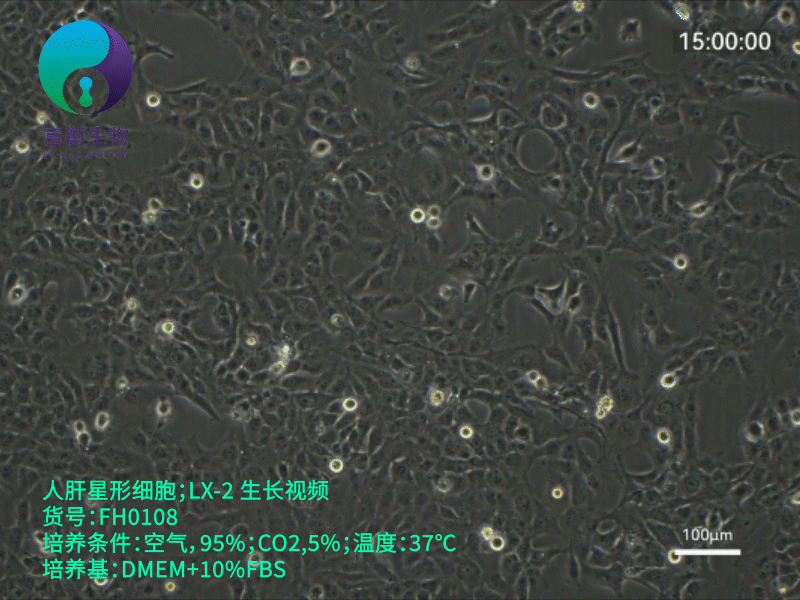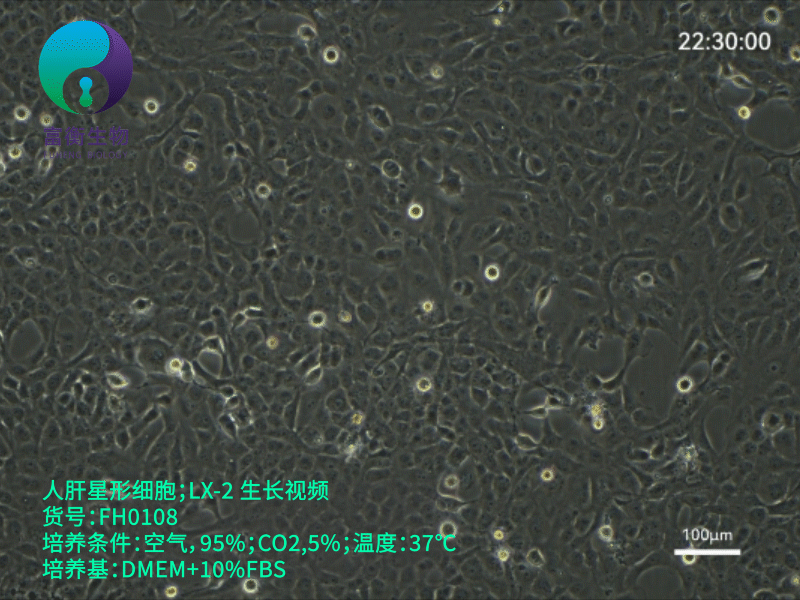
1. 培养条件优化
- 培养基:推荐使用低糖DMEM(含1 g/L葡萄糖)或RPMI-1640,添加10% FBS、1%青霉素-链霉素。注意:高糖环境(如4.5 g/L葡萄糖)可能加速细胞自发激活,干扰实验结果。
- 传代控制:传代比例1:3至1:4,避免过度稀释导致细胞应激。使用低浓度胰酶(0.05% Trypsin-EDTA)消化,时间控制在3-5分钟,减少膜蛋白损伤。
2. 激活方案与验证
- 经典激活剂:TGF-β1:5-10 ng/mL处理24-48小时(需预实验优化浓度)。PDGF-BB:20 ng/mL联合使用可增强促纤维化表型。
- 功能验证指标:α-SMA:Western blot或免疫荧光检测(激活后表达显著升高)。胶原分泌:ELISA检测I型胶原(COL1A1)或羟脯氨酸含量。qPCR:检测纤维化相关基因(如TIMP1、MMP2/9、CTGF)。
3. 常见问题与解决方案
- 细胞增殖缓慢:检查血清批次质量(建议使用同一品牌、同一批次FBS)。确保培养箱CO₂浓度稳定(5%),避免pH波动。
- 激活效率低:确认细胞密度(建议70-80%融合时处理)和刺激剂活性(分装保存避免反复冻融)。联合使用细胞因子(如TNF-α或IL-1β模拟炎症环境)。
- 支原体污染:定期用PCR检测,污染时使用含抗生素(如Plasmocin™)的培养基处理。
前沿研究应用
- 表观遗传调控研究:
- 通过CRISPR/dCas9技术靶向DNA甲基化(如DNMT抑制剂)或组蛋白修饰(如HDAC抑制剂),探索纤维化相关基因的沉默/激活机制。
- 单细胞测序与异质性分析:
- 揭示LX-2亚群在激活过程中的功能分化和关键调控网络(如Notch或Hedgehog通路)。
- 药物递送系统评估:
- 测试纳米载体(如脂质体或外泌体)靶向LX-2的效率,评估抗纤维化药物(如吡非尼酮、索拉非尼)的缓释效果。
- 类器官与微流控芯片整合:
- 构建肝-星形细胞-免疫细胞共培养的“肝芯片”,动态监测纤维化进展及药物干预效果。
与原代HSCs及其他细胞系的对比
特性
LX-2细胞
原代HSCs
大鼠HSC-T6
来源
人,永生化
人/动物,原代分离
大鼠,永生化
激活状态
部分激活,需诱导
静止(原代)或激活(体外传代)
高度激活,自发分泌胶原
功能稳定性
传代后可能漂变(P15后慎用)
短寿命(<2周),功能易丧失
高稳定性,但种属差异显著
应用场景
机制研究、药物筛选
短期实验、基因编辑验证
大鼠模型配套研究
实验设计建议
- 多组学联合分析:结合转录组(RNA-seq)、蛋白质组(LC-MS/MS)和代谢组(NMR)数据,全面解析LX-2激活的分子网络。
- 体内外模型联动:体外LX-2实验与小鼠肝纤维化模型(如CCl4或胆管结扎)互为验证,提升研究可信度。
- 临床相关性分析:对比LX-2数据与肝纤维化患者样本(如活检组织RNA或血清标志物),筛选潜在生物标志物。
LX-2细胞是肝纤维化研究的“金标准”体外模型,其可控的激活特性和人源性为机制探索及药物开发提供了独特优势。然而,需结合原代细胞验证关键发现,并关注其永生化导致的局限性(如信号通路偏移)。未来可进一步开发基因编辑LX-2亚系(如敲入报告基因或疾病相关突变),推动精准医学研究。




