上海富衡生物科技有限公司品牌商
5 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.3999999999999999
- 0.3999999999999999
- 2.4
- 2.4
品牌商
上海富衡生物科技有限公司
入驻年限:5 年
- 联系人:
刘胜富
- 所在地区:
上海 闵行区
- 业务范围:
抗体、ELISA 试剂盒、细胞库 / 细胞培养、论文服务、试剂、实验室仪器 / 设备、技术服务、耗材
- 经营模式:
代理商 经销商 生产厂商 科研机构
推荐产品
技术资料/正文
上海富衡 | 小鼠胰岛β细胞株;Min6细胞
359 人阅读发布时间:2025-05-08 09:13
Min6细胞系概述
背景与来源:
Min6细胞是小鼠胰岛β细胞株,由日本科学家通过将胰岛素瘤(insulinoma)细胞与转基因小鼠(表达SV40大T抗原)杂交培育而成。该细胞保留了胰岛β细胞的核心功能,包括葡萄糖刺激的胰岛素分泌(GSIS),是研究2型糖尿病、胰岛素分泌机制和β细胞功能的常用模型。
Min6细胞的特点
- 功能特性:
- 胰岛素分泌:对葡萄糖浓度敏感(低糖基础分泌 vs. 高糖刺激分泌),可模拟生理性胰岛素释放。
- 基因表达:表达β细胞标志物(如胰岛素、GLUT2、葡萄糖激酶等),但长期传代后可能逐渐丧失部分功能。
- 极化性:贴壁生长,但细胞间连接较弱,需注意培养条件对功能的影响。
- 局限性:
- 永生化影响:与原代胰岛β细胞相比,Min6的胰岛素分泌能力较低,且对葡萄糖的敏感性可能随传代次数增加而下降。
- 基因稳定性:长期培养易出现功能异质性,需定期检测胰岛素分泌能力。
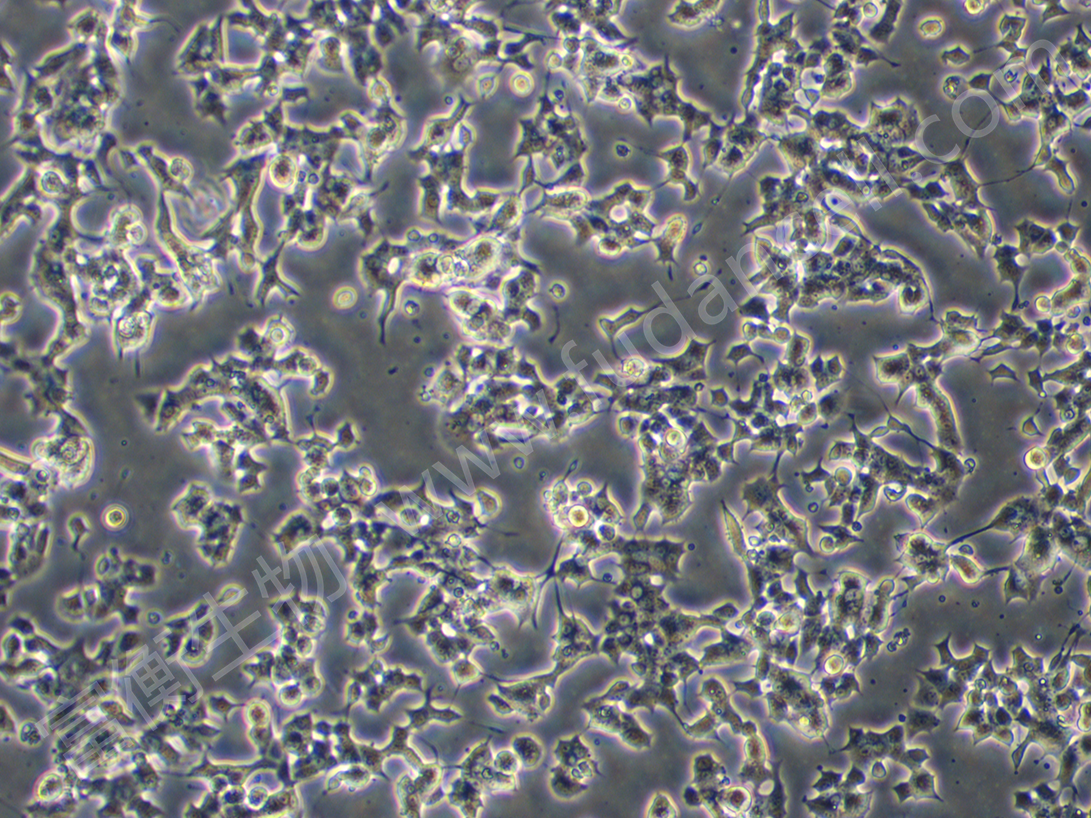
培养条件与实验操作
- 培养基:
- 基础培养基:高糖DMEM(含25 mM葡萄糖)或RPMI-1640。
- 添加物:15% 胎牛血清(FBS)、1% 青霉素-链霉素、55 μM β-巯基乙醇(保护细胞抗氧化应激)。
- 培养环境:37°C、5% CO₂,湿度饱和。
- 传代与冻存:
- 传代比例:1:3至1:5(贴壁细胞,胰酶消化时间控制在2-3分钟)。
- 冻存液:含10% DMSO的完全培养基,液氮长期保存。
- 功能验证实验:
- 葡萄糖刺激胰岛素分泌(GSIS):低糖(2.8 mM葡萄糖)预处理1小时,换高糖(16.7 mM)刺激1小时,收集上清液检测胰岛素(ELISA或放射免疫法)。
- 药物干预:常用药物如棕榈酸(模拟脂毒性)、IL-1β(炎症刺激)、格列本脲(K⁺通道抑制剂)等。
研究应用
- 糖尿病机制研究:
- 研究高糖/高脂诱导的β细胞功能障碍(如胰岛素分泌受损、氧化应激、内质网应激)。
- 探索基因调控(如PDX1、FoxO1)对β细胞存活和功能的影响。
- 药物开发:
- 筛选改善胰岛素分泌或保护β细胞的化合物(如GLP-1类似物、SGLT2抑制剂)。
- 评估抗氧化剂(如N-乙酰半胱氨酸)对β细胞凋亡的抑制作用。
- 基因编辑与信号通路:
- 通过CRISPR/Cas9敲除或过表达特定基因(如IRS2、SIRT1),研究其对胰岛素分泌通路(如PI3K/Akt、AMPK)的调控。
注意事项
- 功能维持:
- 使用低传代细胞(建议P5-P25),传代次数过多可能导致胰岛素分泌能力下降。
- 定期检测胰岛素含量(细胞内)和分泌能力(细胞外),避免功能漂变。
- 实验设计:
- 设置严格的葡萄糖浓度梯度(如2.8 mM vs. 16.7 mM),并同步检测细胞活力(如CCK-8或Calcein-AM染色)。
- 与原代小鼠胰岛或人体β细胞系(如EndoC-βH1)对比,验证实验结果的可信度。
- 培养污染风险:
- Min6对支原体敏感,需定期检测;避免与其他细胞交叉污染。
Min6细胞是研究胰岛β细胞功能的经典工具,其葡萄糖响应性和遗传可操作性为糖尿病研究提供了便利。然而,需注意其与原代细胞的差异,建议结合体内实验(如小鼠模型)和类器官技术,以更全面解析β细胞病理机制。




