上海富衡生物科技有限公司品牌商
5 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.3999999999999999
- 0.3999999999999999
- 2.4
- 2.4
品牌商
上海富衡生物科技有限公司
入驻年限:5 年
- 联系人:
刘胜富
- 所在地区:
上海 闵行区
- 业务范围:
抗体、ELISA 试剂盒、细胞库 / 细胞培养、论文服务、试剂、实验室仪器 / 设备、技术服务、耗材
- 经营模式:
代理商 经销商 生产厂商 科研机构
推荐产品
技术资料/正文
上海富衡 | C3H小鼠骨肉瘤细胞LM8
252 人阅读发布时间:2025-04-25 09:05
一、LM8细胞系的生物学背景与特性
1. 细胞起源与建立
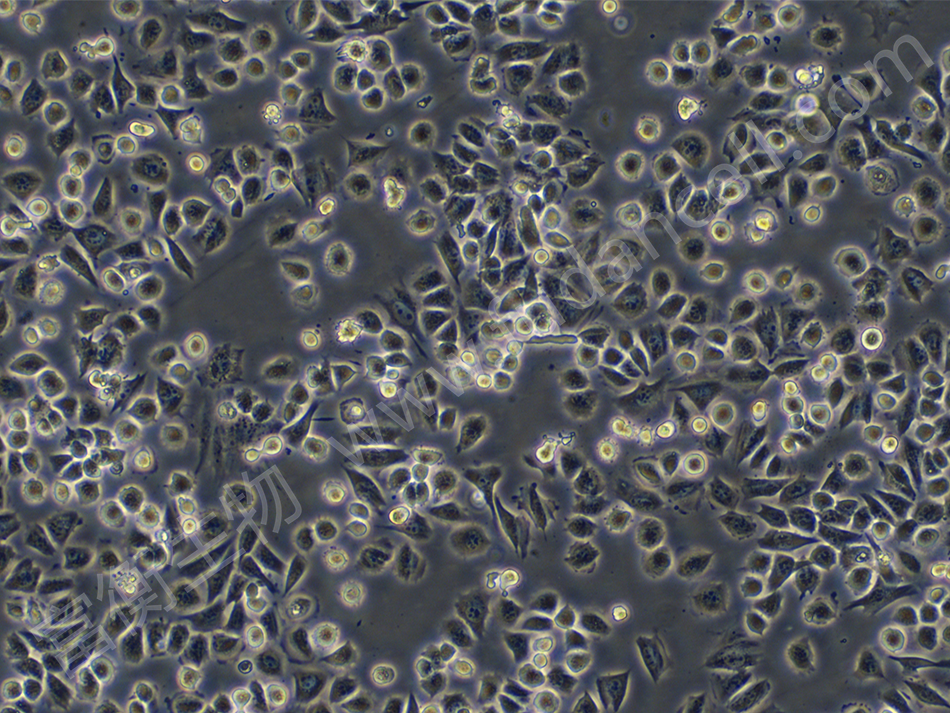
LM8细胞系是一种高转移性小鼠骨肉瘤细胞,源自C3H/He小鼠的自发性骨肉瘤模型。该细胞系通过体内连续传代筛选获得,具有极强的侵袭和转移能力,尤其倾向于转移至肺部和骨骼,是研究骨肉瘤转移机制及抗肿瘤疗法的经典模型。
2. 核心生物学特性
- 表型特征:形态学:呈梭形或多角形,贴壁生长,接触抑制性弱。增殖能力:倍增时间约18-24小时(RPMI-1640培养基,含10% FBS)。转移潜能:皮下接种后4周内可形成肺转移灶(转移率>80%)。
- 分子标记:高表达骨肉瘤相关标志物(如ALK、Runx2、MMP-9)。低表达E-cadherin,与上皮-间充质转化(EMT)相关。
二、LM8细胞在肿瘤研究中的应用
1. 骨肉瘤转移机制研究
- 转移相关信号通路:PI3K/AKT/mTOR通路:调控细胞存活与侵袭。Wnt/β-catenin通路:促进EMT和转移定植。
- 基因编辑研究:通过CRISPR/Cas9敲除MMP-2/MMP-9,验证其在细胞外基质降解中的作用。过表达miR-34a可抑制LM8细胞的肺转移能力。
- 2. 抗肿瘤药物筛选与疗效评价
- 化疗药物测试:对阿霉素(Doxorubicin)敏感(IC50约0.5 μM)。顺铂(Cisplatin)耐药性较高,需联合用药(如与MEK抑制剂联用)。
- 靶向治疗研究:抗血管生成药物(如贝伐珠单抗)可抑制LM8原位瘤的血管密度。免疫检查点抑制剂(如抗PD-1抗体)在LM8荷瘤模型中效果有限,提示其免疫“冷肿瘤”特性。
- 3. 肿瘤微环境与免疫互作
- 巨噬细胞极化:LM8细胞分泌IL-6、TGF-β,诱导M2型肿瘤相关巨噬细胞(TAMs)浸润。
- 成骨与溶骨效应:LM8通过分泌RANKL促进破骨细胞活化,模拟临床骨肉瘤的骨破坏表型。
三、LM8细胞的实验操作指南
1. 细胞培养与传代
- 培养基:RPMI-1640或DMEM高糖培养基,添加10%胎牛血清(FBS)、1%青霉素-链霉素。
- 传代步骤:弃旧培养基,PBS轻柔洗涤2次。加入0.25%胰酶-EDTA(含0.05%胶原酶,提高消化效率),37℃孵育3-5分钟。终止消化后离心(1,000×g,5分钟),重悬接种至新培养瓶(推荐密度:1×10⁴ cells/cm²)。
- 冻存与复苏:冻存液:90% FBS + 10% DMSO,密度1×10⁶ cells/mL。复苏后存活率>90%,需24小时贴壁恢复。
2. 体内转移模型构建
- 原位模型:麻醉小鼠后,于胫骨近端注射LM8细胞(1×10⁶ cells/50 μL PBS)。4-6周后通过X射线或微型CT检测骨破坏及肺转移。
- 尾静脉注射模型:注射2×10⁵ cells/100 μL PBS,模拟血行转移。3周后解剖肺组织,计数转移结节(H&E染色验证)。
3. 体外功能实验
- Transwell侵袭实验:基质胶预包Transwell小室,接种5×10⁴ cells(无血清培养基),24小时后结晶紫染色计数。
- 划痕愈合实验:划痕后每6小时拍照,分析迁移率(ImageJ软件)。
- 3D肿瘤球体培养:使用低吸附板培养,模拟肿瘤组织内缺氧和药物渗透阻力。
四、常见问题与解决方案
1. 细胞污染或形态异常
- 支原体污染:PCR检测(引物针对16S rRNA),使用含5 μg/mL Plasmocin处理1周。
- 成纤维细胞过度生长:提高传代密度,缩短消化时间。
2. 转移模型重复性差
- 细胞状态:避免使用传代次数>30的细胞,冻存早期代次备用。
- 接种技术:使用显微操作仪确保胫骨注射位点准确。
3. 药物实验数据波动大
- 同步化处理:血清饥饿(0.5% FBS,24小时)后同步化细胞周期。
- 阳性对照:每组加入已知敏感药物(如阿霉素)作为内参。




