上海富衡生物科技有限公司品牌商
5 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.3999999999999999
- 0.3999999999999999
- 2.4
- 2.4
品牌商
上海富衡生物科技有限公司
入驻年限:5 年
- 联系人:
刘胜富
- 所在地区:
上海 闵行区
- 业务范围:
抗体、ELISA 试剂盒、细胞库 / 细胞培养、论文服务、试剂、实验室仪器 / 设备、技术服务、耗材
- 经营模式:
代理商 经销商 生产厂商 科研机构
推荐产品
技术资料/正文
上海富衡 | 小鼠乳腺癌细胞4T1细胞
222 人阅读发布时间:2025-04-20 09:18
小鼠乳腺癌细胞4T1是研究三阴性乳腺癌(TNBC)和转移机制的核心工具,其源于BALB/c小鼠的自发性乳腺肿瘤,具有高度侵袭性和多器官转移特性。作为人Ⅵ期乳腺癌的动物模型,4T1细胞在注射至小鼠体内后,可自发形成原发灶并向肺、肝、淋巴结、脑等远端器官转移,且无需摘除原发肿瘤即可观察转移进程。以下从生物学特性、研究应用及培养要点三方面解析其重要性。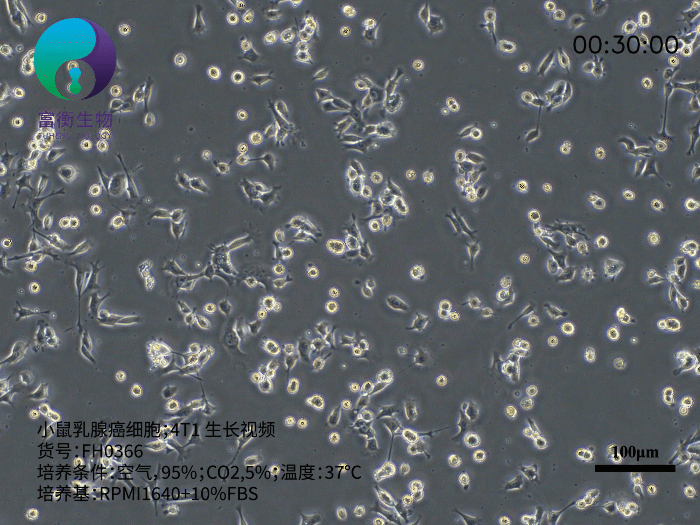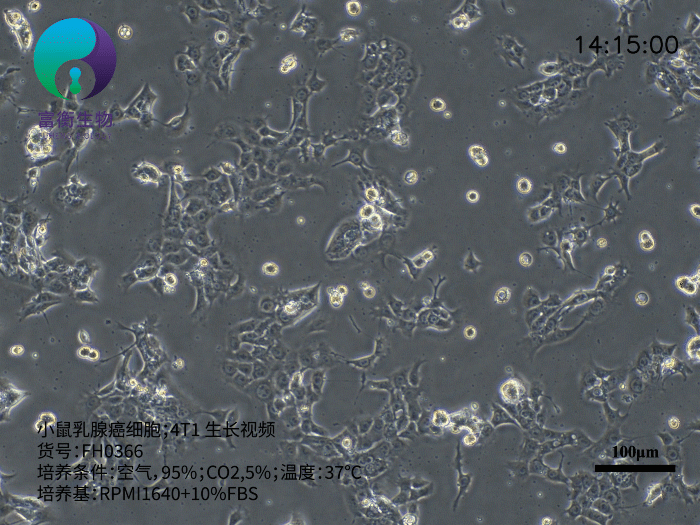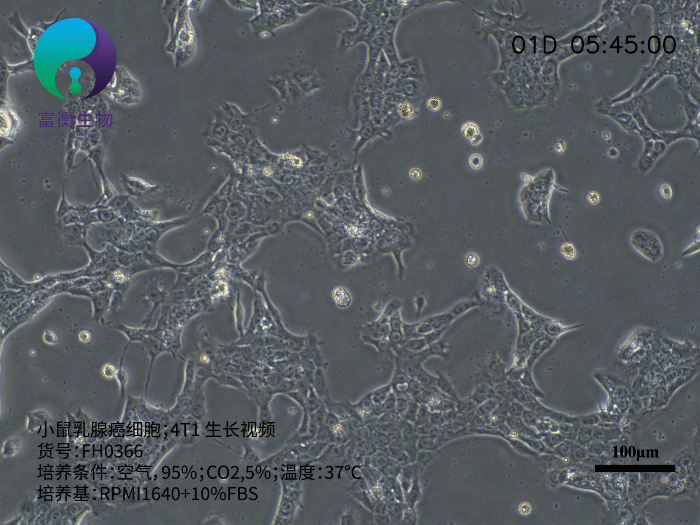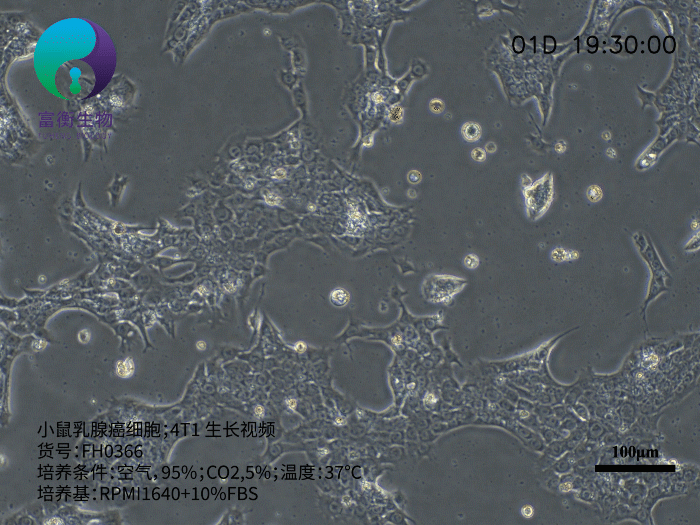
一、生物学特性与模型优势
4T1细胞呈贴壁生长,形态为上皮样,推荐使用含10%胎牛血清(FBS)的RPMI 1640培养基培养。其核心优势包括:
- 高致瘤性与转移性:相比其他乳腺癌模型(如EMT-6或4T07),4T1能形成可见的转移灶,且转移细胞团可少至单个细胞,通过抗6-硫鸟嘌呤特性实现高灵敏度检测。
- 临床相关性:其生长特性与人类三阴性乳腺癌高度相似,尤其适用于研究肿瘤微环境、免疫逃逸及转移信号通路(如STAT3、MMP2/9)。
二、科研与转化医学应用
- 转移机制解析:4T1模型揭示了上皮间质转化(EM和Src通路在转移中的作用。例如,抑制STAT3通路可减少癌细胞迁移和侵袭。
- 药物筛选平台:天然产物研究:迷迭香提取物合成的铁纳米颗粒(Rosemary-FeNPs)及生姜提取物均显示出对4T1细胞的显著细胞毒性。
- 纳米药物开发:紫杉醇固体脂质纳米粒(DTX-loaded SLNs)能抑制4T1的肺转移,疗效优于传统剂型。
- 免疫治疗探索:通过敲除免疫相关基因(如TLR4),可研究肿瘤微环境对治疗响应的影响,为免疫检查点抑制剂提供实验基础。
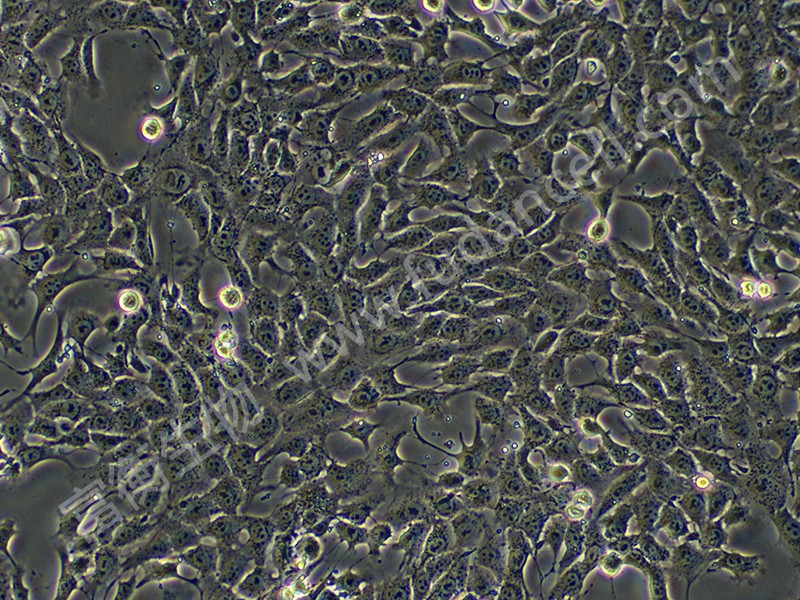
三、培养要点与注意事项
- 传代与消化:细胞需在80%汇合度时传代,推荐1:6-1:8比例。消化时间较长(5-15分钟),建议分步消化:首次消化后收集脱落细胞,剩余细胞二次消化以确保单细胞悬液。
- 污染与碎片控制:培养中常见黑点(细胞代谢产物或碎片),可通过PBS润洗或低速离心清除。避免使用反复冻融的血清以减少蛋白沉淀。
- 冻存与复苏:推荐使用含10% DMSO的无血清冻存液,程序降温后存于液氮。复苏时需快速融化并离心去除冻存液,以维持细胞活性。
4T1细胞凭借其高度转移性和临床相关性,成为乳腺癌研究的核心模型。从机制解析到药物开发,其在基础与转化医学中均展现不可替代的价值。随着基因编辑技术(如CRISPR/Cas9)和活细胞成像的应用,4T1模型将继续推动精准肿瘤治疗的发展




