4 个回答
loveliufudan
制备MHC(主要组织相容性复合物)四聚体用于检测抗原特异性的丁细胞增殖是一个复杂的实验过程。以下是一般的步骤概述:
1. 克隆T细胞:从免疫动物或人体中获得特定的T细胞克隆,这些细胞在识别和结合特定抗原时会发生增殖。
2. 提取MHC分子:从目标组织或细胞中提取目标MHC分子,通常是MHC I或MHC II分子。
3. 生物素化:将目标MHC分子与生物素标记的分子(例如生物素化的二抗)进行反应,以引入生物素标记。
4. 四聚体形成:将生物素化的MHC分子与荧光标记的四聚体结合配体(例如荧光素化的琼脂糖),形成MHC四聚体。
5. 细胞染色:将目标T细胞与MHC四聚体进行孵育,使四聚体与特定的T细胞受体结合。
6. 流式细胞术分析:通过流式细胞仪对T细胞进行分析,以确定是否发生了四聚体与T细胞受体的结合,进而确定抗原特异性的丁细胞增殖。
huarenqiang5
一、MHC四聚体染色基本操作流程
(一)所需主要试剂和设备
(1)欲检测的细胞或全血;
(2)荧光染料标记Anti-CD8抗体或其它抗体;
(3)离心机、流式细胞分选仪等。
(二)基本操作流程
细胞准备
1)外周血单核细胞、脾细胞、淋巴细胞、常规细胞系细胞等,以2-5×107/ml的密度重悬于FACS Buffer(PBS+ 2%小牛血清+0.1%叠氮钠;建议使用时新鲜配制),制备成细胞悬浮液。
2)取25ul细胞悬浮液滴加入微孔培养板或FACS试管。
Staining Cocktail制备
3)制备2X Staining Cocktail:FACS Buffer+ MHC四聚体(建议稀释比例为1:50~1:100)+ Anti-CD8/FITC抗体或其他用作内参的抗体(请参考其说明书进行稀释)。
染色孵育
4)取25ul 2X Staining Cocktail,滴加入步骤2中的微孔培养板或FACS试管,与细胞悬浮液混匀。(注意:使用移液器轻柔上下吹打混匀,尽可能避免产生气泡。)
5)在冰上或其他已通过实验优化确认的最佳温度条件下,避光孵育60 分钟。
洗涤
6)加入150ul FACS Buffer至微孔培养板每孔或2-3ml FACS Buffer至FACS试管,轻柔混匀,避免形成气泡,1200 rpm离心5 min,小心除去上清液,尽可能不要触碰到细胞沉淀,减少细胞损失。(注意:对于具有传染性或危害性的样本,可考虑使用吸引器,轻柔吸掉上清液,尽可能不要触碰到细胞沉淀,减少细胞损失。)
7)重复步骤6,再洗涤2次。
细胞固定&流式分析
8)将细胞重悬于200ul固定液(PBS+1%多聚甲醛(PFA))中,使用流式细胞仪进行样本分析。
土井挞克树
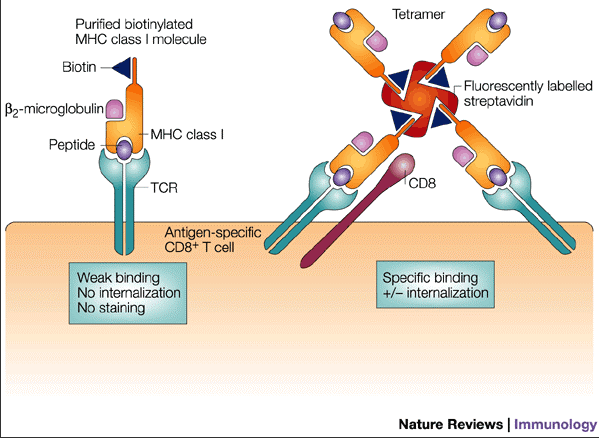
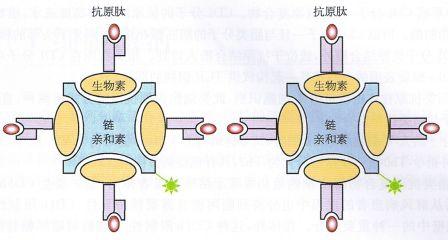
MHC-肽四聚体技术,其具体原理是借助生物素-链霉亲和素系统,将 MHC-肽复合物四聚化,可与细胞表面的多个 TCR 结合,从而大大提高了MHC-肽复合物与TCR 的亲和力和稳定性。
sswei
MHC四聚体染色基本操作流程
(一)所需主要试剂和设备
(1)欲检测的细胞或全血;
(2)荧光染料标记Anti-CD8抗体或其它抗体;
(3)离心机、流式细胞分选仪等。
(二)基本操作流程
细胞准备
1)外周血单核细胞、脾细胞、淋巴细胞、常规细胞系细胞等,以2-5×107/ml的密度重悬于FACS Buffer(PBS+ 2%小牛血清+0.1%叠氮钠;建议使用时新鲜配制),制备成细胞悬浮液。
2)取25ul细胞悬浮液滴加入微孔培养板或FACS试管。
Staining Cocktail制备
3)制备2X Staining Cocktail:FACS Buffer+ MHC四聚体(建议稀释比例为1:50~1:100)+ Anti-CD8/FITC抗体或其他用作内参的抗体(请参考其说明书进行稀释)。
染色孵育
4)取25ul 2X Staining Cocktail,滴加入步骤2中的微孔培养板或FACS试管,与细胞悬浮液混匀。(注意:使用移液器轻柔上下吹打混匀,尽可能避免产生气泡。)
5)在冰上或其他已通过实验优化确认的最佳温度条件下,避光孵育60 分钟。
洗涤
6)加入150ul FACS Buffer至微孔培养板每孔或2-3ml FACS Buffer至FACS试管,轻柔混匀,避免形成气泡,1200 rpm离心5 min,小心除去上清液,尽可能不要触碰到细胞沉淀,减少细胞损失。(注意:对于具有传染性或危害性的样本,可考虑使用吸引器,轻柔吸掉上清液,尽可能不要触碰到细胞沉淀,减少细胞损失。)
7)重复步骤6,再洗涤2次。
细胞固定&流式分析
8)将细胞重悬于200ul固定液(PBS+1%多聚甲醛(PFA))中,使用流式细胞仪进行样本分析。
相关产品推荐