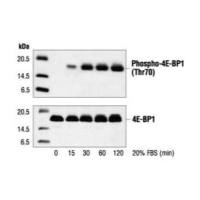
请问,WB电泳的时候,蛋白的上样量为什么是20ug-30ug,蛋白量过多过少会怎么样?蛋白上样量是与WB的测定目的有关吗?
北纬30度到此一游
9 个回答
百泰派克-李工
Western Blot(WB)实验中,蛋白的上样量通常建议在20μg-30μg之间,因为这个量级通常能保证足够的蛋白量以获得清晰的条带,同时又不至于过多导致信号饱和或条带模糊。如果蛋白量过多,可能导致信号过强、条带模糊,甚至可能出现条带堆积的现象;如果蛋白量过少,则可能导致信号弱,难以检测到目标蛋白。
此外,蛋白上样量也与WB的具体测定目的有关。例如,当研究低丰度蛋白或进行定量分析时,可能需要调整蛋白的上样量以获得最佳结果。
feixue7758527w
一般情况下上样量在20ug到30ug之间条带不会太粗也不会太细,蛋白量过多过少都会导致条带结果不好看,影响最后的分析。上样量还是与测定蛋白有关系的。
huarenqiang5
wb上样量太多会导致蛋白条带无法分离,泳道内蛋白条带无法分离。相对表达量=总表达数量Ⅹ相对表达率,根据实际效果来看,一般来讲蛋白量控制在2~5微克Western-blot显印的效果比较好。
上样量太少可能显印不出来,上样量太大显印后可能面积太大颜色过深,对判断可能会有带来干扰。
sswei
wb电泳蛋白上样量太多会导致蛋白条带无法分离,泳道内蛋白条带无法分离。相对表达量=总表达数量Ⅹ相对表达率,根据实际效果来看,一般来讲蛋白量控制在2~5微克Western-blot显印的效果比较好。上样量太少可能显印不出来,上样量太大显印后可能面积太大颜色过深,对判断可能会有带来干扰。
高山云初
低了会无信号,高了实验条带会连在一起或杂带多
粥辰辰辰辰
一般的是20ug左右的总蛋白,但要根据你的目的蛋白在样品中的表达量再调整,如果目的蛋白表达很弱,那就得提高上样的总蛋白量,反之就得调低,不然容易最后显影的时候过曝
此用户已注销
上样量的多少与目的蛋白的丰度有关系,由于组织相对于细胞来说杂质较多,上样量相对的要大些,一般可30~70ug,也有上到100多ug的
周末也要努力呀
表达量高就少上一些,表达量低就多上一些。一般20-30就差不多,很低的要加到80左右,过多条带不好看还容易过曝。
土井挞克树
过多的话背景会非常深,过少的话会不显影
相关产品推荐