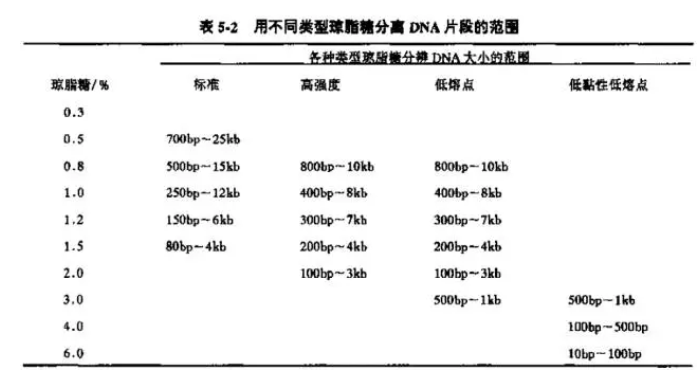
3 个回答
skyye
楼上的回答很好很全面。我想到的一点是尽量用低浓度的胶来跑,转膜时间稍微长一点,然后也要选对合适的marker
loveliufudan
可以考虑以下几点:
1. 凝胶选择:选择适合分离大分子量蛋白的凝胶。对于较大的蛋白质,使用较低浓度的聚丙烯酰胺凝胶(例如8-12%)或聚丙烯酰胺-琼脂糖复合凝胶可以提供更好的分离效果。
2. 蛋白质加载量:减少样品的加载量可以提高分离效果。对于大分子量的蛋白质,尽量将加载量控制在较低水平,以避免过度拥挤和模糊的带状。
3. 电泳条件:优化电泳条件,例如电流和电泳时间,以提高分离效果。较长的电泳时间和较低的电流可以更好地分离大分子量蛋白质。
4. 样品预处理:对于大分子量蛋白质,可以考虑进行样品预处理,例如使用变性剂或蛋白酶进行部分降解,以改善分离效果。
5. 蛋白转移条件:如果您计划进行Western blot等后续实验,确保在电泳后将蛋白质有效地转移到膜上。优化蛋白转移条件,包括时间、电流和转移缓冲液的配方,以确保高效转移和良好的膜上显示。
需要注意的是,不同的膜蛋白可能具有不同的特性和分离难度,因此可能需要根据具体样品和目标蛋白质进行优化和调整。根据实验需求和样品特性,逐步优化上述因素,可以帮助您获得更好的分离效果和可视化结果。
土井挞克树
1.选对凝胶很重要
3种最常见的凝胶包括Tris-Glycine, Bis-Tris and Tris-Acetate.
Tris-Acetate 凝胶的PH为7,跑大分子蛋白会呈现很高的分辨率。跑大分子蛋白时,推荐使用Tris-Acetate 凝胶。
2.凝胶浓度很重要
既然选择了Tris-Acetate 凝胶,还有几个要考虑的问题。凝胶浓度与孔径成反比:浓度越小,孔越大。较大的蛋白质更容易通过较大的孔,所以建议使用低百分比的凝胶,如7%。可以使用梯度凝胶或非梯度凝胶,梯度凝胶非常适合新样本。
2.提高转移buffer中的SDS,减少甲醇
转移buffer的组成至关重要。如果有甲醇存在,大分子蛋白很容易沉淀。通过减少转移buffer中的甲醇百分比(10%或更低)来避免这种情况发生。为了进一步确保蛋白质不会沉淀,考虑添加SDS至终浓度为0.1%。SDS向蛋白添加均匀的负电荷,使得它们更容易从凝胶转移到膜上。
4.选择合适的膜
膜一般有PVDF膜或NC膜。跑大分子蛋白选择PVDF膜。如前面所说,如果有甲醇存在,大分子蛋白很容易沉淀。而PVDF膜不需要在转移buffer中添加甲醇,目的蛋白转印的机会更高。两种类型的膜都有各种孔径尺寸,最常见的是0.2um和0.45um。与凝胶一样,较大的蛋白比较小的更容易穿过大孔隙。大多数蛋白质(> 20kDa)可以用0.45um膜转移,避免使用0.2um孔径。
相关产品推荐

Influenza A H15N2 (A/Australian shelduck/Western Australia/1756/1983) Hemagglutinin Protein (HA1 Subunit) (His Tag)
¥4520
2h极速WB即用型全流程试剂盒(WB检测试剂盒)(Western Blot Kit)
¥420

iBind(Flex) 蛋白质免疫印迹处理系统
询价

Cytochrome c 兔多抗(WB,IHC-P,ICC/IF)
¥999

Influenza A H15N2 (A/Australian shelduck/Western Australia/1756/1983) Hemagglutinin / HA Protein (His Tag)
¥4520