ELISA 实验求助|阴性血清和阳性血清OD值差距不大怎么办
小咪N9P5
我们采用的间接法做ELISA,自己纯化的抗原去包被板子,没有标曲,没有用试剂盒,阴性血清和阳性血清OD值差距不大,请各路大神赐教。
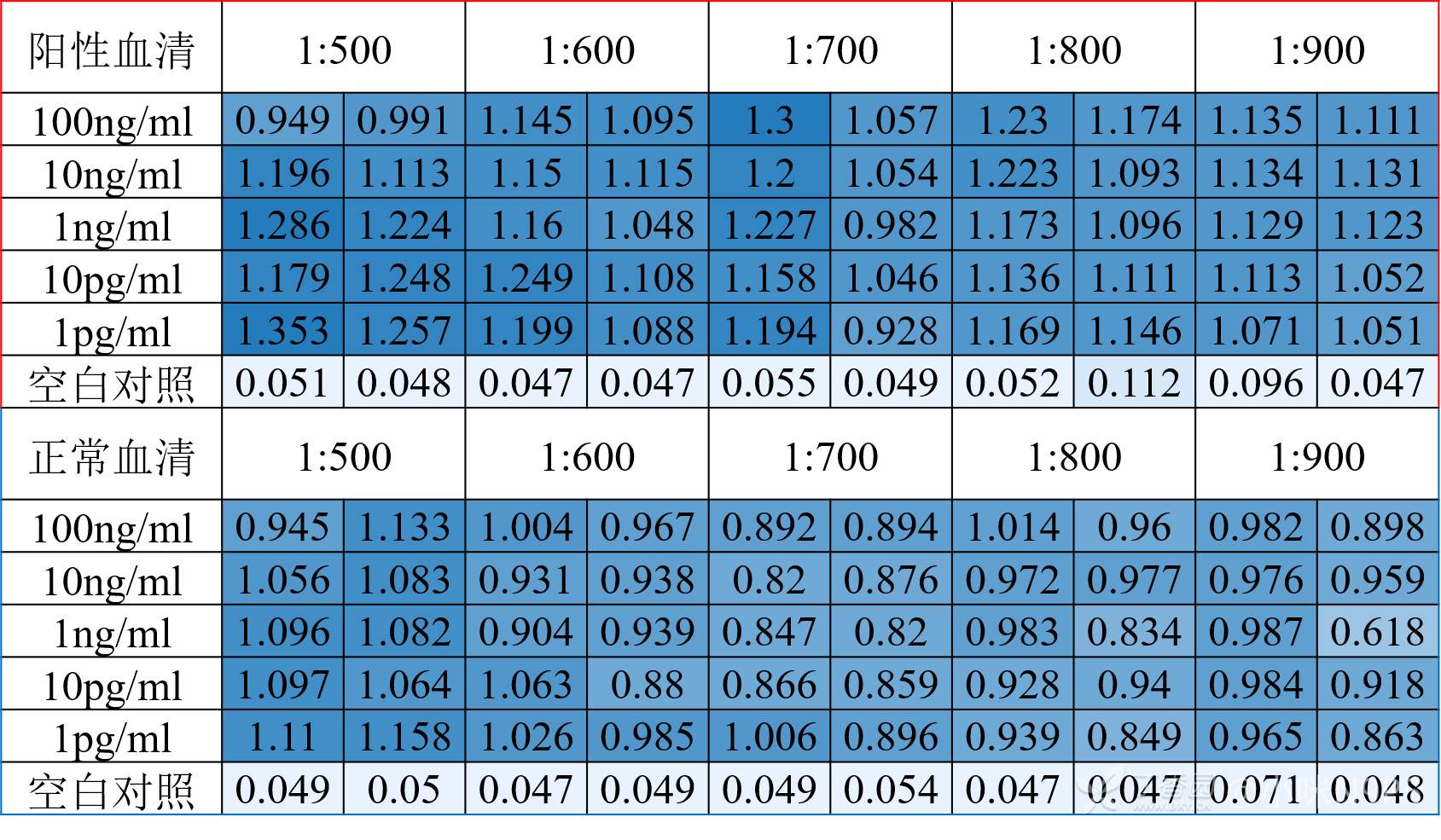
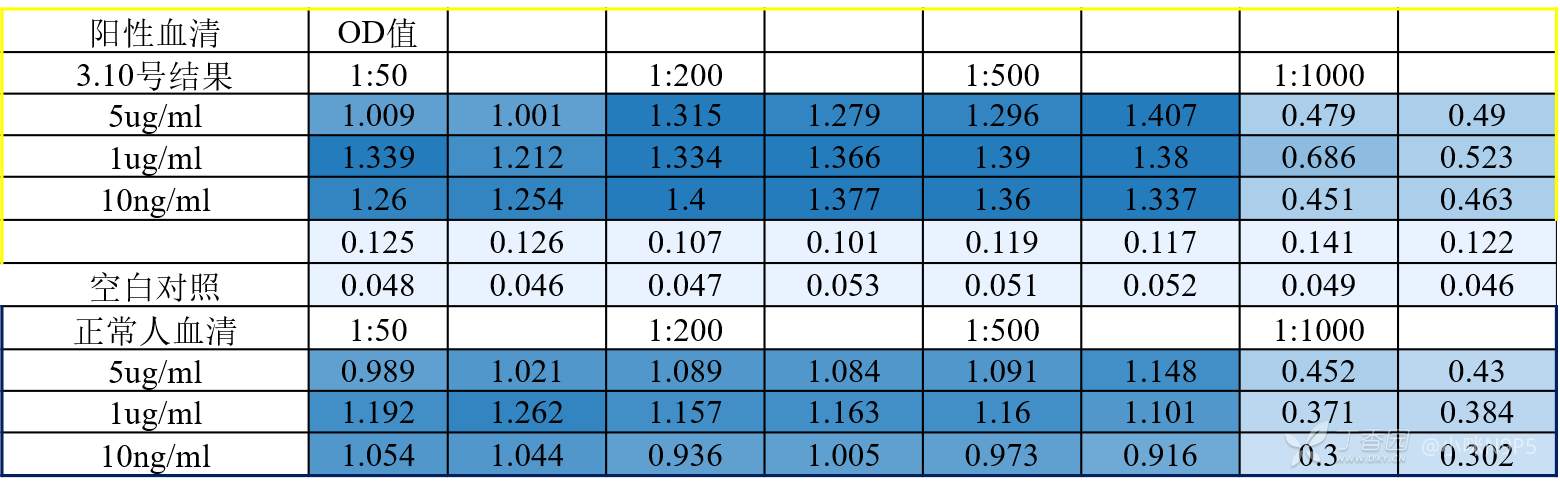
包被浓度从5ug/ml-1pg/ml,血清稀释从1:50-1:1000,都试了差距不大。封闭液试过1%BSA、5%BSA背景值很高,换了0.5%络蛋白、5%络蛋白背景值降低。但是阴性血清和阳性血清差距都不大。
我们的步骤:①:抗原包被:4度过夜孵育,包被液用的是50M碳酸氢钠,PH=9.6;②洗板机1X PBST清洗4次,0.5%络蛋白37度封闭2h;③洗板机1X PBST清洗4次,血清4度过夜孵育,血清稀释用的是0.5%络蛋白;④洗板机1X PBST清洗4次,二抗37度孵育1h,二抗稀释用的是0.5%络蛋白;⑤TMB显色液显色,5min后终止液终止。
下面是ELISA OD值的结果,请各位大神赐教啊 。
。
3 个回答
dxy_er6jr7v4
我遇到了和你一模一样的问题,请问您找到答案了吗?
土井挞克树
你的单抗特异性没那么好,也有可能是你包被抗体的活性不行; 建议提高包被浓度试一试,或者提高单抗浓度。
loveliufudan
可能有以下原因:
抗原的纯度不够高,导致在包被过程中无法充分展露出其表位,或者抗原降解影响了检测的准确性。这种情况下可以尝试提高抗原包被浓度或者尝试使用其他抗原。
包被液的pH值过高或过低,或者包被时间不够长,导致抗原不能被充分包被在酶标板上。这种情况下可以调整包被液的pH值或者增加包被时间。
洗板不彻底,或者使用的洗涤缓冲液的成分不够纯净,导致板上有背景噪音。这种情况下可以增加洗板次数或者更换纯度更高的洗涤缓冲液。
血清样品的稀释不够合适,或者二抗的浓度不够适当,导致信号强度无法区分阴性和阳性样品。这种情况下可以尝试调整血清样品的稀释倍数或者二抗的浓度。
相关产品推荐
相关问答