目的抗体杂带太多,背景杂乱怎么办?
丁香实验
目的基因2133bp,构建到PEGFP-C1这个载体里面,用lipo2000转染到HEK293细胞再提蛋白,浓度4ug/ul左右,上样量30ug,脱脂奶粉室温封闭1.5h,一抗四度过夜,洗膜3次,每次十分钟,二抗室温1h,洗膜4次,每次十分钟,显影。内参actin是CST公司的1:5000稀释,polyG抗体是公司做的1:7000,TAP952抗体是sigma旗下的1:5000已经做了很多次结果还是这样看不到特异性条带,背景也很杂乱。条带从左至右分别是空白(HEK细胞蛋白)、转染空载、转染目的基因,图片从上至下分别是actin、polyG抗体、TAP952抗体,怎么解决?(GFP标签在基因的前后都有连过,而且转染进细胞后都有发荧光,提取细胞的RNA用目的基因的引物也能扩出来;polyG是兔抗,TAP952是鼠抗)
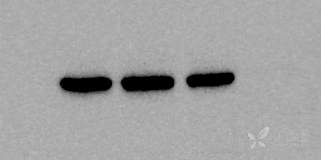
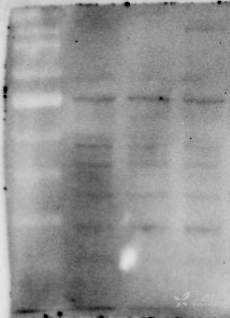
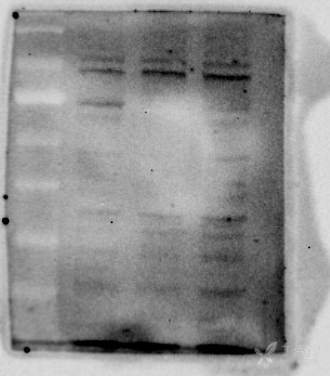
17 个回答
verbalkint
隔壁家的小夜猫子
JCorona
ZZDX-YILILI
dxy_h7vcp8v3
dxy_4uyyu09r
dxy_d4xj2yg7
兔子爱吃鱼
dxy_pni5ki46
z流沙z
一支肾上腺素
Guoood
飞天幻雪
bamboopiggy
dxy_bq4uxnd
小白野蛮成长
vae1476
相关产品推荐

Influenza A H15N2 (A/Australian shelduck/Western Australia/1756/1983) Hemagglutinin Protein (HA1 Subunit) (His Tag)
¥4520
2h极速WB即用型全流程试剂盒(WB检测试剂盒)(Western Blot Kit)
¥420

iBind(Flex) 蛋白质免疫印迹处理系统
询价

Cytochrome c 兔多抗(WB,IHC-P,ICC/IF)
¥999

Influenza A H15N2 (A/Australian shelduck/Western Australia/1756/1983) Hemagglutinin / HA Protein (His Tag)
¥4520




