1. 标本尺寸是多少?奥林巴斯显微镜物镜具备从 1.25 倍至 150 倍的放大倍率范围。这是为应用选择最佳物镜时所要考虑的第一个参数。该参数结合目镜放大倍率就可以确定显微镜的整体放大倍率。2. 所要观察标本中最小特征是什么?显微镜物镜第二个重要的参数是数值孔径(NA)。数值孔径用于衡量其汇聚光线的能力。是用以确定分辨率、焦深和图像亮度的重要因素。具有较大数值孔径的物镜可以汇聚更大范围的光线,从而生成更明亮、更高分辨率的图像。数值孔径对于观察非常精细的结构或在荧光观察过程中检测弱信号也很重要。在确定哪种显微镜物镜可以分辨标本的最小特征时,就需要考虑数值孔径。在权衡选项利弊时,请记住数值孔径范围在 0.04 至 1.7 之间。3. 图像视场和景深要求是什么?视场数或视场直径是光学显微镜中视场的直径,以毫米为单位,并在中间像平面测量。现代平场复消色差透镜和其他专用平场物镜通常具有 22 到 26.5 毫米(与广角目镜组合使用时或会更大)的可用视场。物镜的景深即在图像锐度不发生明显变化情况下的物镜轴向聚焦范围。该值从低数值孔径物镜到高数值孔径物镜变化很大;通常随着数值孔径的增加而减小。4.
光学显微镜三百多年前,人类已经使用光学显微镜观察肉眼无法分辨的微观物体。1662 年,英国物理学家罗伯特·胡克使用自制的显微镜观察软木切片,发现其在放大后呈现出类似修道院单人居室的微观结构-细胞。这是人类历史上第一次观察到细胞。3 年后,胡克出版了首部关于显微镜的著作——《显微图谱》,书中包含大量绘制精美的动、植物机体微观结构图像,开创了科学界利用图画方式进行交流的先河。《显微图谱》的出版使人们意识到微观世界和宏观世界一样丰富多彩,其中有许多未知的奥秘等待着被探索。同一时期,荷兰商人列文虎克(Antoni van Leeuwenhoek,1632—1723 年)制造出当时“最强”的光学显微镜,可实现 300 倍放大率,并持续「称霸」一个多世纪。1676 年春天,列文虎克用显微镜观察雨水发现水中有很多在活动的小生命,并给英国皇家学会寄去了包含这些发现的信件,其中有这样一段话:「我判断,即使把一百个这些小动物撑开摆在一起,也不会超过一颗粗沙子的长度;如果这是真的,那么一百万个这些活物也不够一颗粗沙粒的体积这」。段文字中的「小动物」,就是我们现在熟知的细菌。这是人类首次发现活体细菌,由此开创
1、1590·1920显微镜国产化的漫漫长路显微镜最早由荷兰眼镜制造商父子的发明。此后,英国和德国对显微镜做了进一步的改进。明治时期日本的显微镜通常作为放大镜生产销售的。但其性能逊色于欧洲的显微镜,因此当时从事细菌学研究的科学家不得不依靠昂贵的进口产品。奥林巴斯创始人山下长(Takeshi Yamashita)梦想有一天能够在日本制造出高水准的显微镜。他于 1919 年成立了一家公司,并开始为实现自己的梦想而奋斗。这也标志着山下长 13 年不懈努力的起点。2、1931从单目镜配置转为双目镜配置奥林巴斯在 20 世纪 20 年代中期之前就已经打造出完整的显微镜产品系列。从 1930 年开始,整合更多的功能:方便在观察视野内寻找样品的机械载物台可以用双眼观察的双目观察筒(让观察更加舒适)通过开发复消色差物镜改善光学性能改善聚光镜性能提升拍摄便利性统一镜臂设计3、1946推出 G 系列第二次世界大战期间,为了避免战争造成破坏,奥林巴斯的显微镜和相机工厂迁至长野县。在战后的混乱中,奥林巴斯面临诸多难题。公司设在长野县的伊那工厂(该工厂取代了设在公司总部且在战争中遭到破坏的 Hatagaya 工
挑战pH沉淀反应,常受pH值控制,也是非常经典的化学合成反应,应用非常广泛。此类反应通常在反应釜中进行,反应结束后,液体须与生成的沉淀物(通常为混悬物)分离。但如何实现快速分离?方案沉淀物生成后,继续保持搅拌状态,对混悬液进行过滤和洗涤。如下图所示的实验装置反应釜+过滤模块即可实现反应、过滤流程化。通过反应釜底部出料阀,颗粒状的悬浮液和反应溶液均可直接排入至过滤模块,如图示布氏漏斗和抽滤瓶,并借助真空泵抽滤,快速完成 ...
如今本子多难中不必多说,很多新人想取取经,但经验和智慧不是三言两语能说清楚的,更多的还是具体问题具体分析。这里分享的一些经验更具有普适性,如果都能在写本子过程中一一关照到,想必可以大幅提升中标概率。标书能中标主要是“硬实力”和“软实力”的结合。硬实力就是指标书所具备的不可改变的素质。比如研究方向,研究内容,前期工作/研究背景。这些东西没法编造,是什么就是什么。而这些硬实力中,研究背景又是很能决定一个标书中标与否的关键 ...
离心机的配平原则其主要目的是让转子的转动具有均衡的力学、热力学及表面质量,同时避免产生可能得振动,使设备在高速运行时具有良好的稳定性。
1、摇床的安全转速保护是什么意思?超过设定转速和最高转速时,仪器都会停止,重启瞬间按住时间按钮旋转转速按钮2、摇床是可以用在 CO2 培养箱中吗?可以,但是得看培养箱设置环境,可能会影响使用寿命,湿度最好不要超过 80%3、混匀仪的偏心距是多少?偏心距和周转直径是一样的4、DLAB 的哪款摇床属于脱色摇床?DLAB 全系列摇床均可以做脱色反应,但应用最多的是翘板摇床(-R 系列)。
摇床应用于细胞培养、发酵、分子杂交、蛋白印迹及各类生物化学反应,广泛应用于医学、生物学、分子学、制药、食品、环境等行业。摇床分类一般来说,根据摇床的运动方式来分,可以分为圆周摇床、线性摇床、翘板摇床、三维摇床。圆周摇床圆周摇床通过圆周运动的方式,提供高效的振荡混匀,适配各种培养皿,锥形瓶和培养瓶等;主要应用于细菌重悬、溶解性研究、细菌及酵母培养、提取洗脱过程、诊断检测、杂交、通用混匀、印迹&洗脱等应用等;适合单次混匀较多的样品,样品上下对流效果比较好,浓度较为均匀。线性摇床线性摇床通过往复运动的方式,线性振动筛更具有攻击性;广泛应用于各种电泳凝胶的固定、考马斯蓝染色、脱色时的振荡晃动、硝酸银染色的固定、染色、显影等;适合单次混匀较少的样品,样品与空气接触面积大,使其非常适合萃取等应用。翘板摇床翘板摇床可在样品中产生波浪运动,提供温和的混匀效果;应用于电泳凝胶染色/脱色样品洗涤、酶联免疫吸附(ELISA)洗脱、酶促免疫检测、蛋白合成、杂交印迹/洗脱、免疫沉淀、蛋白免疫印迹(Western Blot)等,同时可用于细胞培养及细胞膜转移,且可放入低温及恒温箱中使用。三维摇床3D 运动
涡旋混匀基于偏心原理,用于混合试管中的液体组分、重悬细胞。涡旋混匀仪的操作使用步骤:将放置在平稳的工作台上,并确保其电源线接地良好;打开电源开关;根据需要,选择合适的转速;按下启动按钮,开始工作;在混匀过程中,可以根据需要适时监控混匀的程度,并根据需要调整混匀的转速;混匀结束后,按下停止按钮,关闭电源开关。涡旋混匀仪的维护保养方法:使用完毕后,将电源开关关闭,并拔掉电源插头;使用干净的湿布或纸巾擦拭表面,清除残留液体和杂质;定期清理工作室,清除堆积的杂质和污垢;配件如有损坏或磨损,应及时更换;注意避免受到较大的震动或碰撞,以免影响使用效果和寿命;定期检查电源线和插头,确保其安全可靠;如需长时间存放,应尽量放置在干燥、阴凉、通风的地方,避免受潮或受热。
1、离心机离心力与哪些因素有关?离心力与转子角度,转子半径,转速均相关,样品容量影响可忽略。2、离心机具体适配那些管子?15ml塑料管,10ml、5ml采血管,2ml、1.5ml离心管,1.8ml、1.5ml冻存管。3、离心机不同材质转子寿命多久?复合型工程塑料转子一般寿命3年,铝合金或钛合金材质5-7年,不锈钢材质10年,转子使用寿命与使用频次有关,以上时间仅供参考。4、离心机转子怎样消毒?高强塑料转子:有样品泄露的话可以用中性吸液清洗,擦拭,但是不可以使用紫外消毒,会使材料变脆影响寿命;铝合金转子:可反复耐受121度,高温高压灭菌。5、转子是否可以消毒?铝合金转子可以高温高压消毒,高强度塑料转子不可以进行高压灭菌和紫外光照射。6、离心管的容量最多可以装多少?建议不超过离心管最大容量的80%。
离心机原理是通过电机驱动转子旋转,产生离心力,在高速旋转中,实验样本混合物中的组分会受到离心力的影响,使密度较高的颗粒向背离轴心的方向移动,而密度较低的颗粒朝向轴心方向移动,这些密度较大的颗粒会沉积在离心管管底,形成沉淀物,从而实现样本中液体与固体颗粒或液体与液体混合物中各组分分离的效果。操作离心机是实验室工作中常见的一项任务。以下是一些值得注意的操作事项:安全性:- 首先确保使用离心机时遵循实验室安全规定,戴上适当的个人防护装备,如实验手套和护目镜;- 在操作前检查离心机是否良好运行,并确保所有附件(如转子、适配器等)已正确安装;- 为了稳定离心机在运行过程中,请将其放置在平稳坚固的表面上;样品准备:- 在进行任何离心之前,务必仔细阅读并遵循相关样品处理方法和说明书;- 确保样品密封良好且标注清楚,在载体(例如:管式离心管)内加入合适量的溶液,以免溢出或破裂造成伤害或污染设备;转子选择与安装:- 根据所需应用选择适当类型和规格的转子。不同大小、形状和容量的转子可用于不同种类和数量的样本;- 在安装转子之前,确保其干净无损,并且转子通道中没有杂质或残留物;离心机配平:根据离心机配平原则
自离心机 19 世纪诞生以来,因转子不配平造成的威胁一直存在着,轻则造成机器转轴的磨损,减少离心机使用寿命,离心管脱离进而造成样品损失,重则造成人员伤亡。而如何避免转子不配平造成的威胁,最好的办法就是学会正确的配平方法!1、固定角转子配平对于固定角转子的配平,通常只需牢记「中心对称法」即可。以下图 12 孔固定角转子配平为例,可遵循这一原则放置样品:2、水平转子配平在实际应用中,最让实验汪头疼的,是给水平转子配平。因为不单要考虑单个吊篮内的离心管是否对称,又要兼顾对面吊篮内的离心管是否平衡。这种情况,配平时要切记两个原则:放置单个吊篮内的离心管,应保证吊篮的重心在吊篮的中心点上;放置对面吊篮内的离心管,应以第一个吊篮放置位置为基准,严格遵循转子中心点对称原则,再放置合适的位置。以下图 4×14 孔水平吊篮转子配平为例,可遵循上述原则放置样品:3、对于奇数管的配平此外,还经常会遇到奇数管配平的情况,多数同学们遇到奇数管配平时,通常会放置一个空白配平管(装上水),这样简单易行,但对于多频次离心、样品质量和体积往往不同的实验时,这种方法就会显得比较麻烦。那遇到这种情况,到底要怎么配平呢?我们
1、真空控制器工作原理是啥?不借助压力传感器怎么实现压力控制的?当系统内真空压力高于或低于设定压力时,控制器内的压力感应器立即动作,使控制器内的开关触点断开或接通,此时设备停止工作;当系统内的真空压力回到设备设定的压力范围时,控制器的压力立即复位,使控制器内的开关触点接通或断开,此时设备正常工作;不借助压力传感器,无法实现压力控制。2、竖直型冷凝器和倾斜型冷凝器, 哪种比较好?对于应用要求来说两者的冷凝效果相当。这两种冷凝器的冷凝面积和冷却效率是一样的。3、旋转蒸发仪和真空控制器,真空泵怎么连接,起什么作用?真空控制器接在旋蒸和真空泵中间,串联。使用旋蒸时,真空度不合适,试剂会出现突沸和暴沸,通过使用真空控制器,与旋蒸串联,可以精确控制旋蒸内部真空度,尤其针对易挥发试剂浓缩,能够得到最大最理想的回收率。也广泛应用于有机试剂的减压蒸馏,对真空度的逐步控制,溶剂的逐步提取使用。4、冷却循环机的冷媒是什么?冷媒是 R404A。化学成份: 五氟乙烷/三氟乙烷/四氟乙烷 混合物旋转蒸发仪中途加抽真空会有什么影响?抽真空会影响样品的沸点,样品原处于沸腾临界点,突然抽真空降低样品沸点,导致样品爆沸冲
旋蒸的基本原理就是减压蒸馏,在减压的条件下,连续蒸馏大量易挥发性溶剂,以达到分离和纯化的目的。旋蒸是研发及分析实验中用于浓缩干燥回收产物的一款必备的基本仪器。即:在减压条件下,将旋转蒸发瓶置于水浴锅中,边旋转边加热,增大蒸发面积(溶剂在烧瓶内壁形成一层液体薄膜)利于瓶内溶液蒸发,样品旋转产生的作用力可以有效的抑制样品的沸腾。影响旋转蒸发仪蒸发效率的四要素:真空度、转速、水浴温度、冷凝器1、真空度影响系统真空最关键且会变化的因素是:真空泵、密封圈和真空管。密封圈:作为承接蒸发管和冷凝管的关键密封件,其耐磨性和耐腐蚀性是关键。常用作密封圈的材质是:PTFE 和橡胶,然而全氟橡胶和 PTFE 的耐磨性和耐腐蚀性都会更好。加了金属的缓冲弹片,耐磨性更好。真空泵和真空控制器:真空泵极限越低,系统的真空值也越低。在蒸馏的时候,需要通过真空控制器设置合理的真空值,保证蒸馏效率,同时避免爆沸。目前隔膜真空泵的极限真空最低可达 2mbar,循环水泵的极限真空大约 50mbar(0.095kpa)。如果预算允许,真空控制器或真空阀就很有必要,它能控制好蒸馏所需的系统真空值。真空管材质:首选硅胶管,因其老化
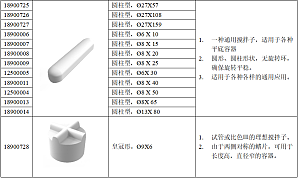
磁力搅拌芯选型指南多用途磁力搅拌芯套装
在搅拌黏性液体时,会出现搅拌子突然与容器底部中心脱离,并开始不规则的跳动,这种现象也称“跳子”现象。如果出现跳子的现象,可能是如下几个原因造成:1、磁子类型不适配搅拌过程中应根据样本体积和粘度,选择适配的磁子类型。市面上常见的搅拌子类型有如下几种:2、磁子尺寸不匹配对应容器的大小选择合适尺寸的磁子,一般来说,30mm 的搅拌子适用于大多数普通的烧杯。3、磁子位置偏心不平衡搅拌过程中,容器应该处于盘面的中心位置,而磁子则应放于容器的中心位置。4、转速超过阈值调速必须由低速逐步调至高速,不允许高速档直接起动,以免搅拌子不同步,引起跳动。
一、通过弹簧的伸缩运动,推动活塞,排除部分空气,利用大气压吸入液体,再由活塞推动空气排出液体。空气活塞式移液器是如何工作的?当设定体积时,活塞移动到适当的位置。当操作按钮按到第一停点时,活塞排出的空气量与体积设置上显示的相同。将吸头浸入液体后,松开操作按钮。这将产生部分真空,并将指定体积的液体吸入尖端。再次按压到第一个停点位置,空气排出液体。为了完全清空尖端,将操作按钮按到第二停点(吹出)。二、外置活塞式移液器是通过分液管或吸头内活塞的连续运动来实现吸液和排液外置活塞式移液器是如何工作的?活塞在尖端内向下移动,与样品直接接触。活塞向上移动,将样品吸入尖端。排液时,活塞下降,所选体积被排出DLAB移液器系列dPette, dPette+, HiPette,TopPette, MicroPette, MicroPette Plus等手动、电动移液器为气体活塞式移液器,StepMate连续分配器为外置活塞式移液器。
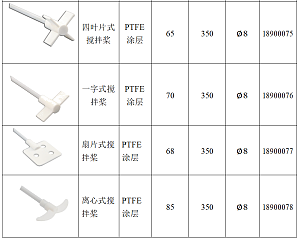
选择正确的搅拌桨能令您的顶置式搅拌器展现出优越的搅拌效果。选择搅拌桨时需要考量:搅拌桨在搅拌时可以引起的介质流动方向;搅拌桨的应用范围主要取决于转速范围和它所能达到的最大扭矩。如果您需要液体中的气体处理<500 mPas,您可以选择径流式搅拌桨如果您需要均质化或悬浮液处理<500 mPas,您可以选择螺旋桨式或叶片式搅拌桨如果您需要中等粘度样品的处理>500 mPas,您可以选择锚式搅拌桨或扇片式搅拌桨搅拌桨应该放置在容器的什么位置?搅拌桨轴杆在容器中心位置搅拌桨距底部距离(h/d)=0.3 桨叶与底部距离;d:搅拌桨直径)只有位置摆放正确,才能获得良好的搅拌效果叶片式搅拌桨建议用中等速度的搅拌适用于低粘度及中等粘度物料的搅拌离心式搅拌桨桨叶可折叠,适用于细口径容器螺旋式搅拌桨建议用中等速度或高速的搅拌适用于中等粘度或高粘度物料的搅拌推荐用于液体中的均质化或悬浮液处理径流式搅拌桨建议用中等速度或高速的搅拌适用于粘度较小或中等粘度物料的搅拌,粘度不超过 500mPas推荐用于液体中气体的处理锚式搅拌桨建议用低速的搅拌适用于中等粘度和高粘度物料的搅拌选择正确的桨不仅可以充分发挥顶置搅拌的优
1、拧钉/磁吸附金属浴有何异同,是不是通过拧钉,就可以加大转速的设置?拧钉款金属浴主要还是给配套磁珠法的客户前处理使用,拧钉和磁吸都需要通过模块下面的铜块去识别转速,不是拧钉款就可以无下限设置转速。2、金属浴加热块,薄款和非薄款什么区别?薄款升温快,温度过冲稍大;非薄款,升温相对较慢,但温度稳定性好,过冲较小或无过冲。3、金属浴模块都是什么材质?大部分是铝材质,一部分是ABS工程塑料+铝材质。4、金属浴温度不稳定或过高是什么原因?可能是加热器或者温度控制器出现故障,建议检查加热器和温度控制器,及时修理或更换故障部件5、金属浴使用过程中注意事项①每次使用前后,用棉签沾蒸馏水清洗模块的锥孔,保证试管与锥孔壁接触充分;②显示温度(PV)与第三方测量温度相差0.1℃以上时,需要进行温度误差校正;③在使用仪器过程中,禁止按压(校准/ADJ)键;④如果使用在4℃恒温4小时以上的操作,必须清楚模块冷凝水;⑤防止位置需防潮或避免暴露烟尘环境;⑥定期净化设备。