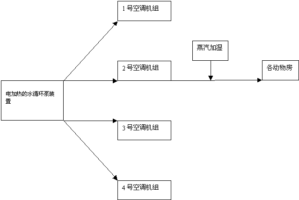
1、环境参数数据采集及报警: 利用飞天通用智能自动化系统进行数据采集。其特点是通用性、开放性、易学性;性价比高。 控制系统示意图见图1。由PC机、打印机、控制柜、检测仪表组成。 图1 控制系统示意图 2.系统功能: (1)数据采集与控制:温度、湿度各31个数据 共31个动物房,温度湿度需要控制。每间温湿度要求不一样。其中一层有狗房、猴房、猫房、豚鼠、家兔,二层有繁殖房、实验室若干。 ...
新建或改建的实验动物设施竣工启用前,须向所属的实验动物管理部门申请进行环境设施的检测,检测合格方能投入使用。实验动物设施是连续运行的,各种环境因素一直处在变动之中,也需要经常性的监测和维护。对实验动物设施的环境条件,国家有标准化的规定,检测项目包括温度、相对湿度、气流速度、梯度压差、空气洁净度、空气落菌数、氨浓度、噪声、照度和换气量等。 环境检测的项目 空气洁净度的指标包括有:空气落菌数,是检测空 ...
兔舍建筑的目的 理想的兔舍,是搞好家兔生产的重要基础条件。兔舍建筑合理与否,直接影响家兔的健康、生产力的发挥和养兔者劳动效率的高低。兔舍建筑是养兔生产的前期工作,至关重要,因而对兔舍建筑的目的必须非常明确。 兔舍建筑的目的,一是从家兔的生物学特性出发,满足家兔的环境要求,以保证家兔健康地生长和繁殖,有效地提高其产品的数量和质量;二是有利于饲养人员日常饲养管理、防疫灭病等方面的操作,从而提高劳动生产 ...
一、目的: 严格控制动物实验环境不受病源微生物的危害;保护动物的福利; 维持屏障环境的生物洁净度;确保动物生产与实验环境的一致性。 二、依据: 《实验动物管理条例》(中华人民共和国国家科学技术委员会令第2号,1988),《实验动物环境及设施》(中华人民共和国国家标准,GB 14925-2001)。 三、屏障环境的消毒: (一)启用前的消毒: 1、清洁屏障环境,检查设施、设备状况。开启空调通风系统自 ...
一、通过与菌体的蛋白质结合,使蛋白质变性、沉淀而达到抑菌或杀菌作用的有:来苏尔、乙醇、福尔马林、红汞、苯酚等。 1.来苏尔,即煤酚皂溶液(含煤酚47%~53%,其余是肥皂和水;煤酚是邻、间、对甲酚的混合物)。将来苏尔用水稀释成5%~10%的水溶液,用作病人用具、排泄物及环境消毒。 2.乙醇,俗称酒精。主要用于皮肤和医疗器械消毒。其75%的水溶液消毒作用最强。浓度过高可使菌体表层蛋白质迅速凝固而妨碍 ...
1.消毒液: 甲醛和高锰酸钾。 2.灭菌原理: 灭菌(Sterilization)是指杀灭档案上所含微主物(包括霉菌、细菌、繁殖体和芽胞)的方法。消毒(Disinfections)是指杀死霉菌,病原微生物的方法。一般消毒剂在常用的浓度下,只对细菌、霉菌的繁殖体有效,对于芽胞则需要提高消毒剂的浓度和延长消毒时间。 甲醛灭菌原理:甲醛与霉菌、细菌蛋白质结合,可使之变性致死。 高锰酸钾灭菌原理:能使菌体 ...
因实验或诊断目的而使用动物的实验人员要有道德上的职责,尽量照顾好动物,应尽量避免给动物带来不必要的痛苦或伤害。同时必须为动物提供舒适、卫生的笼具和足量、卫生的食物、饮水。实验结束时,必须以仁慈方式处死动物。 由于安全保障方面的原因,动物室应是一个独立分开的部分。如果它与实验室毗连,则设计上应当同实验室的公共部分分开,并便于清除污染与杀灭虫害。 和实验室一样,动物设施主要根据所研究微生物的危险度评 ...
按照“实验动物环境与设施”国家标准(1994)规定,实验动物环境设施分为四等,控制程度从低到高,依次为开放系统、亚屏障系统、屏障系统和隔离系统。 开放系统 通常为单走廊专用房舍,采用自然通风或设有排风装置,有防虫、防鼠设施,要求笼具和垫料消毒、使用无污染的饲料,人员进出有一定的防疫措施。这类设施仅适用于普通级动物。该系统通常分为三个区域:前区,包括检疫室、办公室、休息室等; ...
BSL-1生物安全实验室 根据国家标准GB19485-2004《实验室生物安全通用要求》规定: 1)无需特殊选址,普通建筑即可,但应有防止节肢动物和啮齿动物进入的设计。 2)每个实验室应设洗手池,宜设置在靠近出口处。 3)在实验室门口处应设持衣装置,个人便装与实验室工作服分开放置。 4)实验室的墙壁、天花板和地面应平整、易清洁、不渗水、耐化学品和消毒剂的腐蚀。地面应防滑,不得铺设地毯。 5 ...
在基础化学品、精细化工产品、医药品生产中,通常都会涉及到大量悬浮液的固液分离操作。几十年来,推送式离心机和刮刀离心机已经被证明在分离工艺中可以有效地节约大量能耗。基于在此领域的多年经验,FERRUM现将其先进的离心机产品分为四大类,并且开创了降低客户总体投资成本的新概念与新思路。 推送式离心机 推送式离心机最显著的特点在于其独特的设计,能够实现固液分离工艺的连续性操作。固液混合物通 ...
银杏叶中的黄酮类物质是主要有效成分之一 银杏黄酮有强烈的清除细胞内自由基的作用能降低细胞的氧化代谢对脑和四肢动脉血流失调引起的一系列心脑血管疾病有明显和独特的疗效。银杏叶中的黄酮类物质含量占干叶的0.8%~3.5%随品种、地理分布和季节变化而异。传统的提取工艺比较成熟,工艺路线如下: 原料预处理 浸提& ...
(一)差速离心法 它利用不同的粒子在离心力场中沉降的差别,在同一离心条件下,沉降速度不同,通过不断增加相对离心力,使一个非均匀混合液内的大小、形状不同的粒子分部沉淀。操作过程中一般是在离心后用倾倒的办法把上清液与沉淀分开,然后将上清液加高转速离心,分离出第二部分沉淀,如此往复加高转速,逐级分离出所需要的物质。 差速离心的分辨率不高,沉淀系数在同一个数量级内的各种粒子不容易分开,常用于其他分离手段 ...
离心是研究如细胞核、线粒体、高尔基体、溶酶体和微体,以及各种大分子基本手段。一般认为,转速为10~25Kr/min的离心机称为高速离心机;转速超过25Kr/min,离心力大于89Kg者称为超速离心机。目前超速离心机的最高转速可达100Kr/min,离心力超过500Kg。 (一)、差速离心(differential centrifugation) 在密度均一的介质中由低速到高速逐级离心,用于分离 ...
等密度离心分离样品主要是根据被分离样品的密度。在这种离心分离方法中,要用介质产生一种密度梯度, 这种密度梯度覆盖了待分离物质的密度,这样,通过离心使不同密度的颗粒悬浮到相应的介质密度区。在这种梯度离心中,颗粒的密度是影响最终位置的惟一因素,因此用这种方法分离颗粒,主要是根据被分离颗粒的密度差异。只要被分离颗粒间的密度差异大于1% 就可用此法分离。 蔗糖或者甘油(它们的最大密度是1.3g/cm3) ...
这一方法需要用蔗糖或甘油制备轻微的连续密度,然后将待分离的样品加在离心管的最上层,形成一狭窄的带,再通过较长时间的离心。在离心过程中,大小、形状、密度不同的颗粒就会分开,最后收集各区带得到要分离的物质。在此方法中,分离介质对被分离的物质必须是中性无害的,并且密度梯度较低,底部的密度比管顶部的密度大,建立密度梯度的目的是防止扩散。重要的是,待分离颗粒的密度比离心管中任何部分介质的密度都要大。常用的是 ...
:离心旋转超重力-膜分离技术:LiXinXuanZhuanChaoZhongLi-MoFenLiJiShu :03100089:1424134 :0000000:20030109 :20030618:00000000 :00000000 :发明专利 :B01D63/16;B04B1/00 :邵显东、谭军 :ShaoXianDong、TanJun :山东(37) :山东省淄博市临淄区雪宫南区25#楼 ...
Centrifugation is a process used to separate or concentrate materials suspended in a liquid medium. The theoretical basis of this technique is the effect of gravity on particles (including macromolecu ...
目的 研究离心沉淀对尿沉渣有形成分定量检测准确性的影响和影响程度。 方法 以红细胞尿液为标本,分别进行离心和不离心沉淀的定量检测,检测结果用t检验统计分析。 结果 红细胞离心和不离心沉淀的定量检测结果差异有显著性(P〈0.05)。结论 造成离心法尿沉渣定量计数结果明显低于实际数量的因素主要是有形成分离心沉淀不完全和在离心过程中细胞的溶解破坏。 ...
一、 概论 在密度梯度离心中单一样品组份的分离是借助于混合样品穿过密度梯度层的沉降或上浮来达到的。梯度液的密度随着离心本经的增大而增加。密度梯度可以予形成,也可以在离心过程中自形成,经常,密度梯度的可以分为:速率一区带(Rate-30nal)离和等密度(Isopycnic)离心。 在速率一区带离心中混合样品的以很薄的一层铺在梯度液的上部,在离心过程中由于不同组份"颗粒"在梯度液 ...
等密度离心分离样品主要是根据被分离样品的密度。在这种离心分离方法中,要用介质产生一种密度梯度, 这种密度梯度覆盖了待分离物质的密度,这样,通过离心使不同密度的颗粒悬浮到相应的介质密度区。在这种梯度离心中,颗粒的密度是影响最终位置的惟一因素,因此用这种方法分离颗粒,主要是根据被分离颗粒的密度差异。只要被分离颗粒间的密度差异大于1% 就可用此法分离。 蔗糖或者甘油(它们的最大密度是1.3g/cm3)通 ...