Mol Cell:杨薇等揭示 DNA-PK 的激活机制以及自磷酸化对 NHEJ 通路的重要作用
丁香实验
DNA 双链断裂可由外在因素(电离辐射和活性氧等)或内在因素(DNA 复制错误和 V(D)J 重组等)造成,从而激发 DNA 损伤应答,包括 DNA 修复、细胞周期调控、细胞衰老和细胞凋亡等。
DNA 损伤应答由 PIKK(phosphoinositide-3-kinase-related kinase)家族蛋白激酶催化下游蛋白的磷酸化而启动,包括 DNA-PK(DNA 依赖性蛋白激酶)、ATM(Ataxia Telangiectasia Mutated)和 ATR(ATM-Related and Rad3-Related)三种激酶。
其中,DNA-PK 是非同源末端连接(Non-homologous end joining,NHEJ)通路中的关键蛋白激酶,由 DNA-PKcs(DNA-PK 催化亚基)、Ku70/80 和 DNA 末端组成,其全酶装配会进一步招募 NHEJ 相关的连接酶和修复蛋白,包括 DNA 连接酶 IV、XRCC4(X-ray cross complementing protein 4)、XLF(XRCC4-like factor)和 Artemis 等。
由于激酶结构域的底物结合口袋被其自身的 PRD(PIKK regulatory domain)所阻挡,apo 状态的 DNA-PKcs 的激酶活性处于抑制状态,DNA-PKcs 只有在结合 DNA 末端和 Ku70/80 后,激酶活性才会被完全激活,从而启动 NHEJ 通路。NHEJ 相关突变会引起生长迟缓、胚胎致死以及免疫缺陷等,同时 DNA-PK 还是关键的癌症药物靶点。
DNA-PKcs 和 DNA-PK 大部分结构只有中等分辨率(4.3-6.6 Å),且存在建模错误 [1-3]。最近,Blundell 组报道了 3.24 Å 的 apo-DNA-PKcs、3.9 Å DNA-PK 单体和 7.24 Å DNA-PK 二体等的冷冻电镜结构,DNA-PK 二聚化由 Ku80 的最靠近 C 端的 ⍺ 螺旋所介导,揭示了 NHEJ 通路初期 DNA 末端远端匹配的可能机制 [4]。
尽管如此,以上所有报道的结构都为抑制态,激酶结构域的激酶活性中心都处于封闭状态,无法解释 DNA-PKcs 是怎么结合 Ku70/80 和 DNA 末端以及怎么被它们激活的,且由于冷冻电镜 map 的局部分辨率不够高,无法较精确地描述蛋白 - 蛋白和蛋白 - DNA 作用界面以及无法解释已报道的 DNA-PKcs 的关键致病突变和磷酸化位点。
2020 年 12 月 31 日,Molecular Cell 在线发表了美国国立卫生研究院消化道、糖尿病和肾病研究所杨薇院士课题组与 Martin Gellert 院士课题组的研究成果:Structure of an activated DNA-PK and its implications for NHEJ(陈学敏博士为论文第一作者)。
他们报道了 DNA-PKcs-DNA 末端和 DNA-PK 全酶的不同状态的冷冻电镜结构(3.2-4.3 Å),首次展示了激活态 DNA-PK 结构,解释了 DNA-PKcs 亚基识别 DNA 末端和 DNA-PK 逐步被 Ku70/80 和 DNA 末端所激活的分子机制,为 NHEJ 通路中 DNA-PK 如何招募其他修复蛋白提供重要启示。

首先,作者通过在 DNA 的关键弯曲位置引入一个切刻,发现 DNA-PK 的激酶活性可被提高至少 3 倍。使用此切刻 DNA,组装和纯化了 DNA-PK 蛋白样品并收集了大量冷冻电镜数据。
电镜数据处理和 3D 分类发现,样品中存在不同状态的复合物结构,有 DNA-PKcs-DNA 末端(不含 Ku70/80)和 DNA-PK 全酶两种组装状态,而两种状态又可细分为 6 种构象,命名为复合物 I-VI。
复合物 I 和 II 为 DNA-PKcs-DNA 末端复合物的两种构象,区别在于 NH1 亚结构域和 DNA 末端的位置不同,其激酶结构域都处于抑制状态。
复合物 III-VI 为 DNA-PK 全酶的四种构象,其中 III-V 为抑制态,通过 Ku70/80 和 DNA 末端的充分结合以及 DNA-PKcs 的全局构象变化,最终 DNA-PK 转变为激活态复合物 VI。
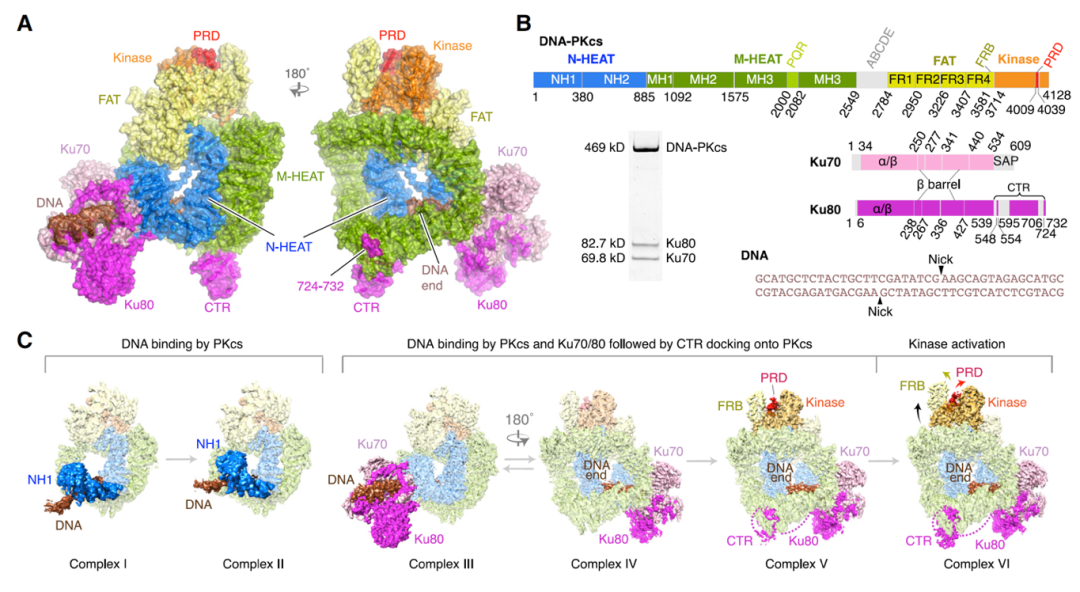
不同状态 DNA-PK 的总体结构。
A 为激活态 DNA-PK 复合物 VI 的结构模型;B 为 DNA-PK 各亚基的结构域分布图以及全酶样品的 SDS-PAGE 图;C 为不同状态复合物的冷冻电镜 map。
通过结构比对发现,在 DNA-PK 激活过程中:DNA-PKcs 的 M-HEAT 结构域在复合物 I-VI 之间只发生了轻微构象变化;N-HEAT 的 NH1 亚结构域则发生逐步向上的构象变化,收紧 N-HEAT 环,最终与 M-HEAT 的 MH3 亚结构域和 FAT 的 FR2 亚结构域相互作用;FAT 结构域内的相邻 HEAT 重复序列之间则发生相反反向的扭转和拉升,激活态复合物 IV 中 FR2 与 NH1 相互作用;
最终,Ku70/80 和 DNA 末端将 DNA 损伤信号通过 DNA-PKcs 亚基上的 HEAT 重复序列的「彩虹圈式」构象变化传递到激酶结构域,PRD 发生 115° 外翻,解除激酶活性中心抑制态,暴露 DNA-PK 的底物结合口袋,催化 DNA-PK 自身和下游修复蛋白的磷酸化。
令人意外的是,在 DNA-PK 组装和激活过程中,DNA-PKcs 才是识别 DNA 末端的关键亚基,而 Ku70/80 的开放性拓扑结构只能在 DNA 主链上滑动,Ku70/80 通过与 DNA-PKcs 的 N-HEAT 和 M-HEAT 结构域以及 DNA 的相互作用,进一步稳定了 DNA-PK 对 DNA 末端的结合,使 DNA-PK 在激活过程中不会松散。
另外,本研究也更完全的揭示了 Ku80-CTR 结构域在 DNA-PK 激活中的重要作用,除了 Ku70/80 的核心(⍺/β 结构域和 β 桶结构域)与 DNA-PKcs 的 N-HEAT 个 M-HEAT 结构域相互作用以外,Ku80-CTR 的螺旋 548-555、结构域 595-706 和螺旋 724-732 也分别固定了 DNA-PKcs 底座的四个角,对 DNA-PK 激活起到固定和促进作用。
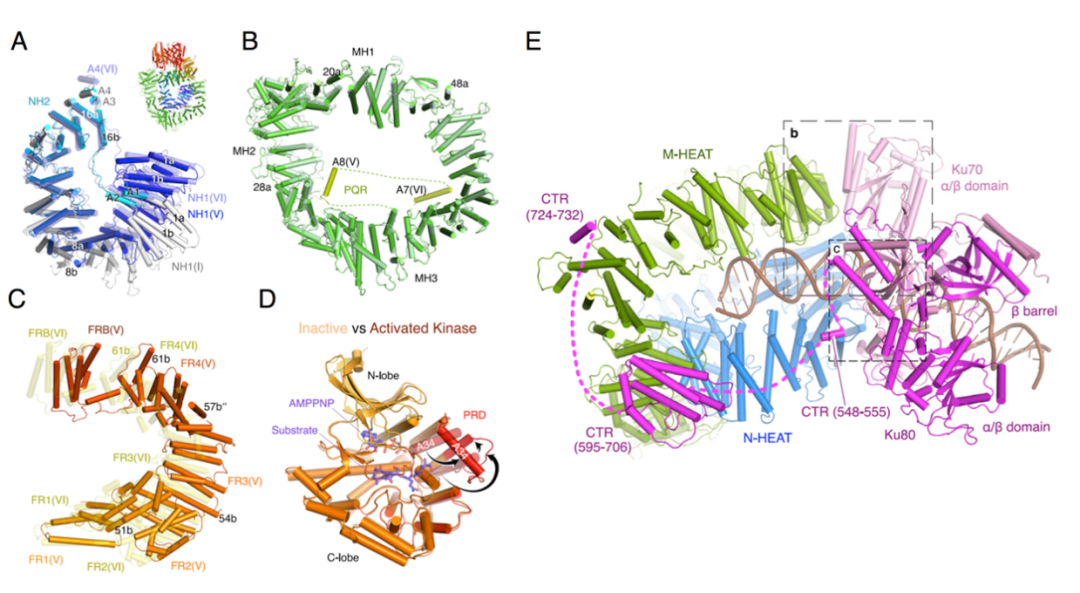
DNA-PK 激活过程中的结构变化 A-D 分别为 N-HEAT、M-HEAT、FAT 和激酶结构域的构象变化,PQR 无序部分结构显示为虚线,底物 ATP 和多肽显示为棍棒模型,E 为 激活态 DNA-PK 复合物 VI 的底部视图。
DNA-PKcs 含有两簇自磷酸化位点,位于 M-HEAT 两个无规区域,其中,PQR 簇位于氨基酸序列 1982-2093 之间,ABCDE 簇位于氨基酸序列 2566-2788 之间。
虽然由于结构柔性,PQR 簇的大部分 loop 区域无法搭建,但电镜 map 能够观察到其两个螺旋 A7 和 A8 ,以前的结构模型错误地将 A7 归属于 Ku80 的 CTR 结构域。
同时,由于分辨率的提高以及晶体结构 [1] 的硒代甲硫氨酸位置,也可以正确的定位和搭建螺旋 A8,PQR 簇远离 DNA-PK 自身活性中心且大部分结构都位于 DNA 末端延长位置上,因此作者推断 PQR 簇只能被相邻的 DNA-PK 分子磷酸化,以及其磷酸化将会在影响 DNA-PK 对 DNA 末端的结合和对其他修复因子的招募。
在以前发表的 DNA-PK 结构中,只有 Blundell 组观察到了 ABCDE 簇的部分结构,位于 M-HEAT 大环内部,而杨薇组冷冻电镜 map 发现 ABCDE 簇位于 M-HEAT 大环外部(由于 DNA 末端与 DNA-PKcs 具有更紧密的结合),紧邻 DNA-PK 自身的激酶活性口袋,提示了 ABCDE 簇可以被 DNA-PK 自身磷酸化。
同时结构比对发现,当 DNA-PK 从抑制态(复合物 V)转变成激活态(复合物 VI),DNA 末端有一个大约 2 Å 的外移,因此可以推断,ABCDE 簇在自磷酸化过程中,DNA 末端变得更容易被 NHEJ 修复蛋白所捕获,从而被相关核酸酶、连接酶和修复蛋白处理和修复。
另外,ABCDE 簇的去磷酸化可以恢复 DNA-PK 让 DNA 末端再次被保护起来,从而形成 DNA-PK 的磷酸化 - 去磷酸化循环。
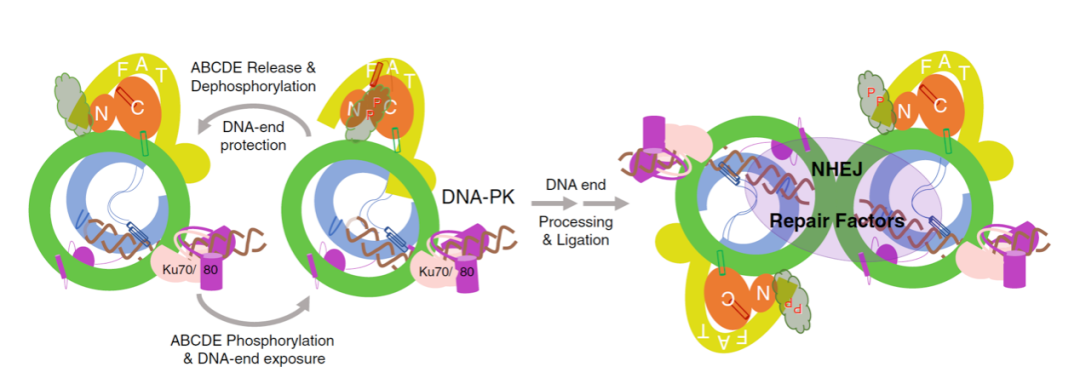
综上,该工作报道了 DNA-PK 的从抑制态到激活态一系列冷冻电镜结构,展示了断裂 DNA 末端是怎么被 DNA-PKcs 亚基感应并组装成全酶结构,再通过 DNA-PKcs 上的 HEAT 重复序列将信号传导到激酶活性中心,将 DNA-PK 从抑制态转变成激活态,从而磷酸化 DNA-PK 自身和大部分 NHEJ 修复蛋白,最终启动 NHEJ 通路来完成 DNA 修复。
另外,该工作还提出,「彩虹圈式」的 HEAT 重复序列具有结构柔性,可能在很多含 HEAT 重复序列的蛋白中具有重要调控功能,如 PIKK 激酶、凝集素(Condensin)、黏附素(Cohesin)和核转运蛋白(Karyopherin)。