Science 重磅 | 日本团队揭秘首个睾丸因子,有望促进不育症治疗和设计男性避孕药
男性的生育能力取决于睾丸生精小管中精子的生成及其在通过附睾中的成熟过程。已有研究表明,附睾最近端(IS)的发育受损的小鼠模型,拥有形态正常但不能使卵子受精的精子。
据推测,在睾丸中合成的因子(lumicrine factor)会被释放到肾小管内腔,并影响 IS 的发展和功能,若睾丸和附睾之间的信号传递不当则可能导致男性不育。
然而,这些关键的因子仍处于人们的想象推测当中,具体是什么,一直以来都是困扰研究者们的难题。
2020 年 6 月 5 日,来自日本大阪大学免疫学前沿研究中心的 Daiji Kiyozumi 等在 Science 杂志发表论文:NELL2-mediated lumicrine signaling through OVCH2 is required for male fertility,该工作鉴定了第一个已知的 lumicrine 因子 —— 生殖细胞分泌蛋白神经表皮生长因子 2(NELL2)。证明了 NELL2 可特异性结合孤儿受体酪氨酸激酶 c-ros 癌基因 1 (ROS1),并介导 IS 的分化,表明 NELL2 在驱动小鼠的 IS 发育方面的关键作用。该成果对于解决男性不育或开发男性避孕药具有重要的意义!

研究内容
1999 年,一个孤儿受体酪氨酸激酶 c-ros 癌基因 1(ROS1)被确定为第一个在小鼠 IS 中表达的假定 lumicrine 受体。研究发现缺失 Ros1 的小鼠 IS 发育受损,并且精子无法使卵子受精。这导致了一种假设,即出生后睾丸产生的因子通过附睾来刺激 IS 的分化和发育,并驱动上皮细胞产生对精子成熟至关重要的分子。
然而未解决的问题集中在哪些睾丸细胞类型(生殖细胞和 / 或体细胞)负责 lumicrine 因子的合成?这些因子是什么?以及它们如何刺激上皮细胞分化和影响精子成熟?
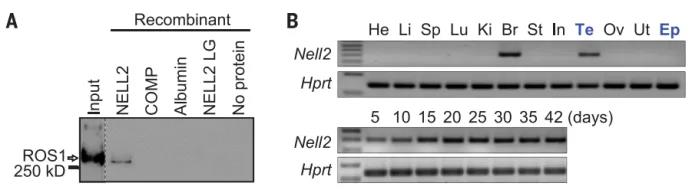
高通量筛选发现 lumicrine 关键因子 NELL2为了鉴定附睾孤儿受体 ROS1 的睾丸配体,研究人员从 GSE640 芯片数据(36,939 个斑点)中选择了 1706 个斑点作为基质基因,筛选了在精子发生过程中上调的睾丸分泌蛋白。结果发现,重组 NELL2 蛋白在体外特异性结合重组 ROS1。
在野生型(WT)小鼠中,NELL2 在睾丸和大脑中表达,但在附睾中不表达。在生殖细胞缺陷的 KitW/Wv (W/Wv) 小鼠中,NELL2 在大脑中表达,但 IS 不能分化。因此,研究人员专注于睾丸作为 NELL2 的来源,并将精母细胞鉴定为具有 RNA-seq 数据的 NELL2 表达细胞。因为精细胞位于生精小管的血液 - 睾丸屏障内,所以这些数据表明 NELL2 是从睾丸生殖细胞(TGC)分泌的,穿过生精小管的腔,并与附睾上皮细胞的 ROS1 结合。
研究人员构建 Nell2 KO 小鼠,发现雄性不育。以 TGC 特异性表达 NELL2 的 Clgn-NELL2 转基因完全恢复了 Nell2 KO 小鼠的雄性不育,再次排除 NELL2 在大脑中表达调节生育的可能性。研究人员检查了 Nell2 KO 雄性的生殖道,在睾丸中精子产生似乎没有受到影响。相比之下,IS 分化较差。IS 分化始于 2 至 3 周龄,并与睾丸中的时空 NELL 2 表达相对应。Nell2 KO 雄性出生后 IS 完全不分化,此后终生不能再分化。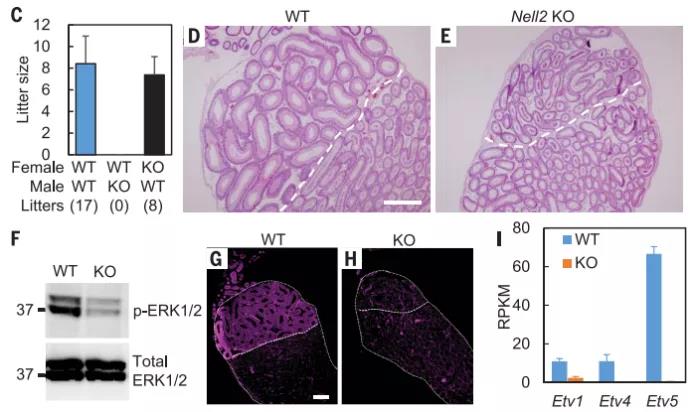
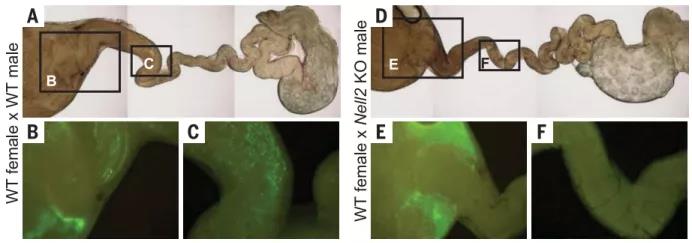
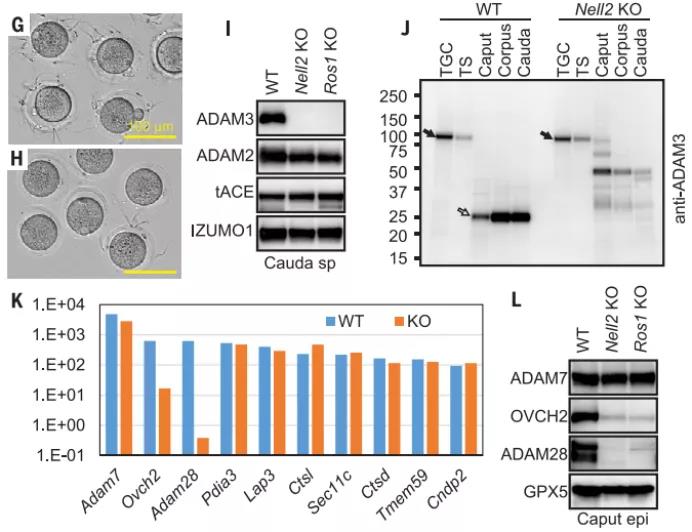
当用 Acr-egfp 转基因观察到射入雌性生殖道的精子时,在子宫中观察到了 Nell2 KO 精子,但在输卵管中却没有观察到,这表明 Nell2 KO 精子在通过子宫输卵管交界处(UTJ)的过程不足。研究发现在 Nell2 KO 附睾尾精子中前体精子表面跨膜蛋白金属肽酶 3(ADAM3)没有被正确地加工成成熟的 ADAM3。其他生育力相关精子蛋白在 Nell2 KO 睾丸和精子中的表达未受到严重影响。这些结果表明 Nell2 KO 附睾缺失了一个参与适当 ADAM3 加工的关键蛋白酶。附睾分泌蛋白酶是 ADAM3 加工和
雄性育性必须的
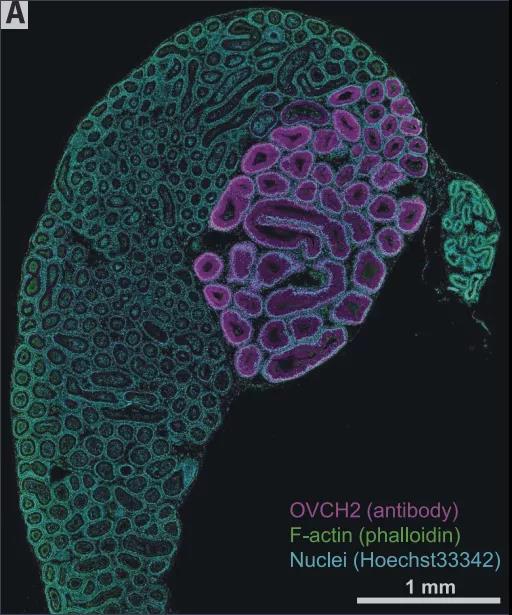
通过 RNA-seq 和免疫印迹分析,研究人员发现,两种蛋白酶 OVCH2(卵糜酶 2)和 ADAM28 在野生型附睾中强烈表达,但在转录本和蛋白质水平上在 Nell2 KO 附睾中高度下调。研究人员构建了 Ovch2 KO 和 Adam28 KO 小鼠。尽管在 Ovch2 KO 小鼠中 IS 分化没有受到损害,但是 Ovch2 KO 精子中的 ADAM3 加工异常,并且 Ovch2 KO 雄性小鼠由于精子无法转运 UTJ 和与 ZP 结合而变得不育。由于 OVCH2 在 NELL2 的下游,Ovch2 不仅是附睾特异的,OVCH2 蛋白也非常局限在附睾的 IS。这些结果表明,精子 ADAM3 加工和随之而来的精子受精能力需要附睾特异性和分泌的蛋白酶 OVCH2。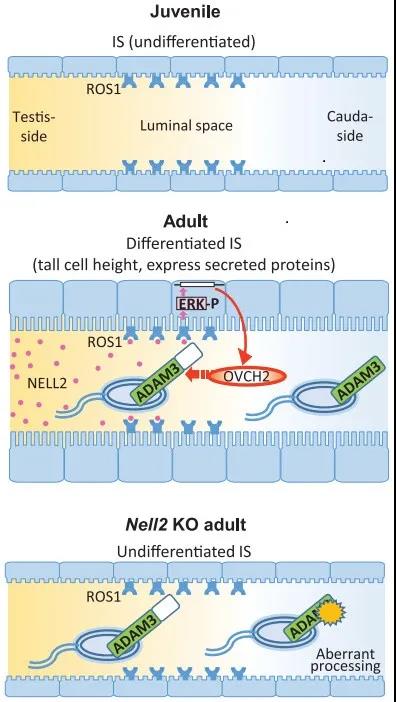
该研究表明存在 lumicrine 信号通路,其中睾丸分泌蛋白(NELL2)通过 ROS1 通路信号调节附睾成熟和随后分泌的附睾蛋白酶(OVCH2)处理 ADAM3 的精子受精能力。NELL2 由睾丸中发育的生殖细胞产生,通过管腔进入附睾,触发其分化。分化后的精子分泌许多蛋白质,包括作用于 ADAM3 精子的蛋白酶(如 OVCH2),使精子完全发挥功能。由于在 Nell2 KO 附睾头中多种基因被下调,很可能除了蛋白酶以外,附睾管腔因子也以不同的方式调控精子成熟。同样,由于 OVCH2 是男性生育所必需的,因此 OVCH2 可以处理精子成熟所需的其他精子和 / 或附睾蛋白。另外,该研究展示的雄性生殖道的 lumicrine 理论也可以更广泛地应用于其他发生管腔内流的器官。鉴于精子在转录和翻译上是沉默的,精子成熟的过程很大程度上归因于附睾上皮细胞的活动,包括精子蛋白翻译后修饰、增强和加工。2008 年,Baker, MA 等人就发现从附睾近端(头)收集的精子与远端(尾)收集的精子,有 50 多个蛋白表达差异以及 77 个磷蛋白变化。
生殖细胞和附睾之间的 lumicrine 信号的特性可以深刻地改变对男性不育症的理解,进一步促进治疗不育症的新方法的发展或设计非激素男性避孕药。在多达 80% 的男性不育症病例中,精子数量足够,但功能却受到影响。受精失败的一个主要原因是精子不能识别和结合透明带,类似于 lumicrine 缺乏的小鼠模型的表型。鉴于高达 60%的男性不育病例的病因尚不清楚,因此研究有缺陷的 lumicrine 系统将为诊断和治疗提供新的途径。此外,针对 lumicrine 系统也可能提供一个有效的策略,为长期以来广受欢迎的男性避孕药确定可行的药物靶标。[1] Kiyozumi, D., Noda, T., Yamaguchi, R., Tobita, T., Matsumura, T., Shimada, K., Kodani, M., Kohda, T., Fujihara, Y., Ozawa, M., et al. (2020). NELL2-mediated lumicrine signaling through OVCH2 is required for male fertility. Science 368, 1132-1135.[2] Baker, M.A., Hetherington, L., Reeves, G., Muller, J., and Aitken, R.J. (2008). The rat sperm proteome characterized via IPG strip prefractionation and LC-MS/MS identification. Proteomics 8, 2312-2321.[3] Lord, T., and Oatley, J.M. (2020). Testicular-borne factors affect sperm fertility. Science 368, 1053-1054.![预览]()