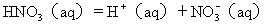相同元素两原子间形成的共价键为非极性键,不同元素原子间形成的共价键为极性键。极性键中,共用的电子对偏向电负性大的原子,因此电负性大的原子带部分负电荷(δ-),而电负性小的原子则带部分正电荷(δ )。电负性差异越大,键的极性将越大。多原子分子的极性除了与各键的极性有关外,还决定于分子空间构型。若分子对称性很高,使各键极性相互抵消,则分子将无极性。如C—O是极性键,但CO2是直线型对称分子,两键极性相 ...
极性分子与非极性分子相遇时,极性分子的固有偶极产生的电场作用力使非极性分子电子云变形,且诱导形成偶极子,固有偶极子与诱导偶极子进一步相互作用,使体系稳定。这种作用力为诱导力。这种作用力同样存在于极性分子间,使固有偶极矩加大。
由于分子中电子和原子核不停地运动,非极性分子的电子云的分布呈现有涨有落的状态,从而使它与原子核之间出现瞬时相对位移,产生了瞬时偶极,分子也因而发生变形。分子中电子数愈多、原子数愈多、原子半径愈大,分子愈易变形。瞬时偶极可使其相邻的另一非极性分子产生瞬时诱导偶极,且两个瞬时偶极总采取异极相邻状态,这种随时产生的分子瞬时偶极间的作用力为色散力(因其作用能表达式与光的色散公式相似而得名)。虽然瞬时偶极存 ...
假如有一组分P和杂质一起溶于一种液体溶剂(如水)中,我们可以在其中加入一种与该液体溶剂(水)互不相溶的但对组分P有较大溶解能力的另一种溶剂(常用有机溶剂,此处称萃取剂),这样就可以将组分P从水溶液中抽提到有机溶剂中,从而使其与杂质分离。这种利用物质在互不相溶的两种溶剂中的溶解度的不同,即利用分配定律来实现的分离及纯化操作称作液液萃取(常称萃取);若用溶剂将固体物质萃取分离,工业上称浸取。为了保证萃 ...
在一定温度下,难挥发的非电解质稀溶液的蒸气压降低值与溶解在溶剂中溶质的物质的量的分数成正比,即Δp=p x质式中Δp——溶液蒸气压降低;p ——纯溶剂的蒸气压;x质——溶质的物质的量分数。由于 x质 x剂=1,所以 x质=1-x剂, ...
“相似”是指溶质与溶剂在结构上相似;“相溶”是指溶质与溶剂彼此互溶。例如,水分子间有较强的氢键,水分子既可以为生成氢键提供氢原子,又因其中氧原子上有孤对电子能接受其它分子提供的氢原子,氢键是水分子间的主要结合力。所以,凡能为生成氢键提供氢或接受氢的溶质分子,均和水“结构相似”。如ROH(醇)、RCOOH(羧酸)、R2C=O(酮)、RCONH2(酰胺)等,均可通过氢键与水结合,在水中有相当的溶解度。 ...
当两液体完全混溶时,它们彼此不能分层。而彼此不互溶时,它们便分成两层。密度小的在上层,密度大的在下层。分配定律是表示某溶质在两个互不相溶的溶剂中溶解量之间的关系。在一定的温度与压力下,某物质在互不相溶的两相中达到溶解平衡时,该物质在两相中浓度的比值是一个常数,这就是分配定律。这个常数称分配系数: 式中K——分配系数;cA和cB——分别为某溶质在溶剂A和B中的物质的量浓度。 ...
当溶液由半透膜与纯溶剂隔开后就产生渗透现象。若在溶液一侧外加一个大于渗透压的压力时,水不仅不从溶剂向溶液中渗透,反而从溶液向纯溶剂中扩散,这种现象称反渗透(如图2-3)。利用反渗透可以从海水中提取淡水,也可以用于处理被可溶物污染的废水。研究表明,用反渗透技术淡化海水所需的能量仅为蒸馏法所需能量的30%左右,所以这种方法很有发展前途。反渗透技术的主要问题在于寻找一种高强度的耐高压半透膜,因为绝大多数 ...
早在1916年已提出离子键理论。该理论认为原子生成化合物的过程是电子从一个原子转移到另一个原子,分别变成具有稀有气体单原子稳定电子结构的正、负离子,异号离子通过静电引力形成了分子。原子间的这种键合作用称为离子键。显然离子键中正负离子分别是键的正负两极,离子键是极性键。所形成的化合物是离子型化合物。典型的化合物有NaCl,CsCl等。通常认为电负性相差△X>1.7的金属与非金属元素间易形成离子键。由 ...
现代价键理论强调了分子中相邻两原子间因共享配对的电子而成键,能相当直观并成功地解释物质的化学性质,预测物质的分子结构。但由于过分强调了两原子间的电子配对,而显示出它的局限性,例如小分子B2,O2等的顺磁性价键理论无法解释。分子轨道(molecular orbital,MO)理论自然地、合理地解释了这些现象。MO理论是美国化学家R.S Mulliken约在1932年创立的(获1966年诺贝尔化学奖) ...
价键理论可解释原子采用什么样的空间轨道去形成共价键,但不易预测分子的空间结构。价层电子对互斥理论可相当成功地简便地判断许多共价型分子的几何构型。该理论认为,在多原子共价型分子中,中心原子周围的配体(原子、离子或原子团)的相对几何位置,决定于中心原子的价电子层中电子对数以及为减小排斥力,价层电子对尽可能彼此远离的倾向。分子的几何构型由此时成键原子排列方式来确定。因此确定中心原子的价电子层中电子对数N ...
任何自发的氧化还原反应(ΔrGm<0)均为电子从还原剂转移到氧化剂的过程。例如将Zn片插入H2SO4溶液中,Zn与H2SO4便发生下列反应:Zn(s)+2H (aq)=Zn2 (aq)+H2(g)由于Zn和H2SO4直接接触,电子从Zn原子直接转移给H 离子,因而得不到有序的电子流。随着氧化还原反应的进行,溶液温度将有所升高,即反应中放出的化学能转变为热能。在盛有ZnSO4溶液的烧杯中放入Zn片, ...
电负性差异甚大的原子间靠离子键结合成分子,电负性相近甚至相同的原子是靠原子共享电子,形成共价键而结合成分子的。以氢分子的形成为例。两个自由氢原子从R=∞远处逐渐靠近时,体系势能E的变化。实验指出,两个具有电子自旋顺向平行的氢原子靠近时,其体系的势能上升(虚线),氢原子之间推斥力越来越大,而不能形成稳定的氢分子。当两个具有电子自旋反平行的氢原子靠近时,其体系势能变化如实线所示。在R=R0(74pm) ...
化学反应可分成两类,一类是非氧化还原反应,如前一章所讨论的一些离子互换反应。另一类是本章所要研究的氧化还原反应。所谓氧化还原反应,就是反应中有电子的转移,或者说某些元素的氧化数发生了变化的反应。例如制造印刷电路板时用FeCl3腐蚀Cu的反应:2FeCl3+Cu→CuCl2+2FeCl2 ...
一种将活性物质中化学能通过氧化还原反应直接转换成电能输出的装置。又称化学电池。由于各种型号的原电池氧化还原反应的可逆性很差,放完电后,不能重复使用,故又称一次电池。它通常由正电极、负电极、电解质、隔离物和壳体构成,可制成各种形状和不同尺寸,使用方便。广泛用于工农业、国防工业和通信、照明、医疗等部门,并成为日常生活中收音机、录音机、照相机、计算器、电子表、玩具、助听器等常用电器的电源。原电池一般按负 ...
德国科学家W. Nernst对电极电势产生机理作了较好的解释。他认为:当把金属插入其盐溶液中时,金属表面上的正离子受到极性水分子的作用,有变成溶剂化离子进入溶液而将电子留在金属表面的倾向。金属越活泼、溶液中正离子浓度越小,上述倾向就越大。与此同时,溶液中的金属离子也有从溶液中沉积到金属表面的倾向,溶液中的金属离子浓度越大、金属越不活泼,这种倾向就越大。当溶解与沉积这两个相反过程的速率相等时,即达到 ...
每个原电池都由两个电极构成。原电池能够产生电流的事实,说明在原电池的两极之间有电势差存在,也说明了每一个电极都有一个电势。原电池的电动势E就等于这两个电极的电势差。但到目前为止,测定电极电势的绝对值尚有困难。一般采用规定标准氢电极的电极电势为零来进行比较,从而确定各电极的电极电势的相对值。所谓标准电极电势是指电极反应中有关的离子浓度为1mol·dm-3,气体分压为100kPa时电极的电势,用 表示 ...
与所有的化学平衡一样,当溶液的浓度、温度等条件改变时,弱酸、弱碱的解离平衡会发生移动。就浓度的改变来说,除用稀释的方法外,还可在弱酸、弱碱溶液中加入具有相同离子的强电解质以改变某一离子的浓度,从而引起弱酸或弱碱解离平衡的移动。例如,往HAc溶液中加入NaAc,由于Ac-离子浓度增大,使平衡向生成HAc 的一方移动,结果就降低了HAc的解离度。又如,往NH3水溶液中加入NH4Cl,由于 弱酸溶液中加 ...
凡能给出质子的物质(分子或离子)都是酸;凡能与质子结合的物质(分子或离子)都是碱。简单地说,酸是质子的给体,而碱是质子的受体。酸碱质子理论对酸碱的区分只是以H 的给与受为判据的。例如 HAc(aq)=H (aq)+Ac-(aq)NH4 (aq)=H+(aq)+NH3(aq) 可见,酸可以是分子、正离子或负离子。酸给出质子的过程一般是可逆的。因此,酸给出质子后,余下的部分Ac-、NH3、CO32- ...
碱性氢氧燃料电池用30%~50%KOH为电解液,在100℃以下工作。燃料是氢气,氧化剂是氧气。其电池图式为(-)C|H2|KOH|O2|C(+)电池反应为负极2H2+4OH--4e-=4H2O正极O2+2H2O+4e-=4OH-总反应式2H2 O2=2H2O若H2和O2的分压均为100kPa,30%KOH的物质的量浓度为6.9mol·dm-3,即c(OH-)=6.9mol·dm-3,则 每个电池可 ...