文献挖掘分析系统主要针对客户提供的一个或一组关键词,利用相关算法从PubMed数据库中查找到与之相关的所有基因或蛋白、小RNA、SNP、化合物等信息,并对这些数据进行网络及功能分析。分析的结果作为研究背景和立项依据写进标书中,可以大大提高标书的中标率。
以下文章介绍俩纤维素薄层层析的操作方法以及分配层析的原理。
前言: NusA融合蛋白表达系统于9年前(1999年)由Davis发明,并在2000年由Novagen首先进行商业化设计和开发,特别推荐用于以NusA作为N端标签时提高在大肠杆菌中难溶的重组表达蛋白的可溶性。NusA融合蛋白表达系统面市至今,已经通过一些高通量表达筛选的评估确认其在可溶性改善方面的有效性。关于NusA融合表达蛋白去除或不去除NusA标签,目的蛋白仍然具有活性的报道也有很多。正是由于 ...
若表达蛋白质上含有一段六个His 的片段,而亲和吸附胶上接有镍离子,此蛋白质会特异性地结合到吸着胶体;洗去杂质后可imidazole 洗脱目标蛋白质。
各种蛋白质分子上可能带有不同的电性,经过离子交换管柱,可依其分子带电性的差异而分离开来。
不同大小的蛋白质分子进入胶体过滤管柱,可依其分子量差异分离
蛋白质在细菌中表达后,以反复的冷冻-解冻方法打破细胞,再用硫酸铵把蛋白质沉淀下来,此步骤可以去除大部份核酸、多醣、脂质等杂物。
最简单的反射是单突触反射。由于突触在结构与功能上的特性,决定了反射弧上冲动的传导只能由感受器传向效应器。
最简单的反射是单突触反射。由于突触在结构与功能上的特性,决定了反射弧上冲动的传导只能由感受器传向效应器。
包涵体是外源基因在原核细胞中表达时,尤其在大肠杆菌中高效表达时,形成的由膜包裹的高密度、不溶性蛋白质颗粒,在显微镜下观察时为高折射区,与胞质中其他成分有明显区别。
大肠杆菌表达蛋白以可溶和不溶两种形式存在,需要不同的纯化策略。现在,许多蛋白质正在被发现而事先并不知道它们的功能,这些自然需要将蛋白质分离出来后,进行进一步的研究来获得。
免疫印迹(immunoblotting)又称蛋白质印迹(western blot),它是根据抗原抗体的特异性结合检测复杂样品中的某种蛋白的方法。
Bradford 方法基于考马斯亮蓝G-250 有红蓝两种不同的形式。在一定浓度的乙醇及酸性条件下,可配成淡红色的溶液,当与蛋白质结合后,产生蓝色化合物,反应迅速而稳定。反应化合物在465-595nm处有最大的光吸收值,化合物颜色的深浅与蛋白浓度的高低成正比关系,因此可检测595nm的光吸收值的大小计算蛋白的含量。
2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。这样就可以得到蛋白质等电点和分子量的信息。
大约 30% 基因编码 MPs,膜蛋白占到新药物~50%的靶点。但MP’s 很难被成功表达,在成功解析出结构的蛋白中,只有<1%是膜蛋白。
蛋白质在细菌中表现后,以反复的冷冻-解冻方法打破细胞,再用硫酸铵把蛋白质沉淀下来,此步骤可以去除大部份核酸、多醣、脂质等杂物。
不同大小的蛋白质分子进入胶体过滤管柱,可依其分子量差异分离;是一种广泛应用的partition色析法 (Pharmacia操作手册, Gel Filtration)。
各种蛋白质分子上可能带有不同的电性,经过离子交换管柱,可依其分子带电性的差异而分离开来 (Pharmacia 操作手册,Ion Exchange)。
若表达蛋白质上含有一段六个His 的片段,而亲和吸附胶上接有镍离子,此蛋白质会特异性地结合到吸着胶体;洗去杂质后可imidazole 洗脱目标蛋白质。
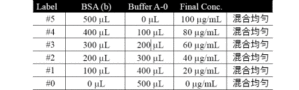
Bradford 的dye-binding method 是利用Coomassie brilliant blue G-250 (CBG) 可与蛋白质结合而变色的特性来定量。(Bradford, 1976);若试样中的蛋白质量较多,则结合到蛋白质而变色的CBG 也多,因而呈色较深。下例是以一组标准蛋白质为对象,制作一条蛋白质量与吸光度的标准校正线。