更多资讯
三月的倒春寒来势汹汹,科研人在奋斗征程中也要注意个人身体健康。本周学术君继续带来 CNS 最新进展,助力大家勇攀科研高峰!1.Nature Metabolism:锌促进雄性小鼠的交感神经支配目前,产热脂肪细胞对交感神经支配的调节尚不清楚。2023 年 3 月 6 日,同济大学栾冰团队在Nature Metabolism杂志发表研究论文Thermogenic adipocyte-derived zinc promotes sympathetic innervation in male mice。该研究表明产热脂肪细胞来源的锌促进雄性小鼠的交感神经支配,确定锌离子(Zn)作为一种产热脂肪细胞分泌因子,促进雄性小鼠棕色脂肪组织和皮下白色脂肪组织的交感神经支配和产热,解析了产热脂肪细胞和交感神经元相互调节的正反馈机制。图 1:来源Nature Metabolism2.STTT:揭示结直肠癌来源的细胞外囊泡的重要作用细胞外囊泡可谓小小的身体,大大的能量,在医学健康领域扮演着重要的角色。2023 年 3 月 6 日,四川大学王自强及韩俊宏共同通讯在Signal Transduction and T
目前,肥胖和超重是许多慢性疾病的主要危险因素。根据世卫组织最新数据显示,全球已有超 10 亿人患有肥胖症,其中包括 6.5 亿成年人、3.4 亿青少年和 3900 万儿童,减肥大业迫在眉睫。在此背景下,「间歇性禁食」(Intermittent Fasting)已发展成为一种备受大众欢迎的减肥方法。间歇性禁食也称有时间限制的进食,通常指在某个时间段内正常进食食物,然后很长一段时间(16-48 小时)内吃很少的食物或者不吃。多项研究表明,间歇性禁食通过控制食物摄入时间可调节代谢功能,从而实现体重的减轻。此外,随机临床试验也揭示,与全天进食相比,限制进食不仅可减轻体重,还有减少腹部脂肪,调节葡萄糖和胰岛素、平衡血压血脂等优势。然而,最新发布在《美国心脏协会杂志》(JAHA)的一项研究表明,就管理体重而言,控制热量的总摄入可能比将进餐限制在狭窄的时间窗口更为有效。2023 年 2 月 7 日,美国约翰霍普金斯大学医学院在JAHA上发表题为Association of Eating and Sleeping Intervals With Weight Change Over Time: The
在哺乳动物中,新生命开始于精子与卵细胞成功相遇,形成受精卵,然后子代携带来自双亲的部分遗传物质。长久以来,这都是自然界中哺乳动物繁衍后代的定律,也是维持种群的重要方式。在鱼类和爬行动物中,还存在一种普遍的繁殖方式,称为孤雌生殖,仅由从未受精的卵母细胞产生后代,但这在哺乳动物的自然繁殖中并未发现。孤雄生殖这一方式更是罕见,仅在一种稀有杂交鱼类和一些无脊椎动物中有发现。2023 年 3 月 8 日,在弗朗西斯·克里克研究所举行的第三届国际人类基因组编辑峰会上,来自日本九州大学的Katsuhiko Hayashi介绍了他们的最新研究:通过将雄性小鼠细胞转化为卵子,他们最终创造了具有两个亲生父亲的小鼠后代。Katsuhiko Hayashi(图片来源:网络)研究人员将携带男性 XY 染色体的皮肤细胞重新编程为干细胞样状态,即所谓的诱导多能干细胞(iPSCs)。然后删除这些细胞中的 Y 染色体,并替换为从另一个细胞「借用」的 X 染色体,以产生具有两条相同 X 染色体的诱导多能干细胞。随后,将该细胞放置在卵巢类器官(一种复制小鼠卵巢内条件的培养系统)中培养,使其变成卵子。并将该卵子与正常精子结合
基因编辑技术在植物中的开发和应用为分子设计育种带来了革命性的变化。基于基因编辑技术建立基因精细调控的方法对于精准设计育种至关重要。目前应用最为广泛的基因表达调控方法,如 CRISPR-Cas、CRISPRi 和 RNAi 等技术只能够实现对基因的完全敲除或将基因的表达抑制到不可预测的水平。利用 CRISPR-Cas9 技术对启动子区域进行编辑,可以在转录层面将基因的表达调控至不同的水平,并产生大量不可预测的数量性状变异。但这种方法将耗费大量精力用以筛选理想的突变体。因此,开发新的能够可预测地精细调控基因表达的方法可以极大拓展现有的基因表达调控工具箱,为作物遗传改良提供有力的技术支撑。上游开放阅读框(uORF)是真核生物 mRNA 上普遍存在的翻译调控元件,对基因主效开放阅读框 (primary open reading frame, pORF) 的翻译具有抑制作用。2018 年,中国科学院遗传与发育生物学研究所高彩霞研究组率先利用 CRISPR-Cas9 技术对 uORF 进行编辑,建立了精细上调内源基因翻译的方法,并利用该方法培育出了维生素 C 含量显著提高的生菜种质。2020 年,
质谱成像(MSI)具有同时显示组织中已知或未知生物分子相对丰度和空间分布的能力,已广泛用于癌症和其他疾病的组织学诊断。然而,由于组织样品的复杂性和异质性,全面绘制代谢物的分布图仍然具有挑战。尤其是对于那些具有广泛生物功能但丰度较低的代谢物,需要开发一种无针对性的,高灵敏度,覆盖范围广,化学特异度高的成像方法,以可视化多种代谢物在原始状态下的空间分布。本课题组对自主研发的气流辅助解吸电喷雾电离质谱成像(AFADESI-MSI)进行了优化,通过非靶向分析,在大鼠脑、肾脏和人食道癌组织中观察到数千种代谢物,为分子组织学研究提供了有力的分析工具。中国医学科学院药物研究所再帕尔·阿不力孜教授、贺玖明研究员课题组在 Advanced Science发表的题为“A Sensitive and Wide Coverage Ambient Mass Spectrometry Imaging Method for Functional Metabolites Based Molecular Histology”的研究论文,通过优化的空气动力辅助解吸电喷雾质谱成像(AFADESI-MSI)技术,绘制了生物样
绝对定量时代——引领慢病毒行业新标准高大上的慢病毒是怎样炼成的(一)慢病毒活性滴度用什么单位?看TU!看 TU!看 TU!TU=transducing units,即每毫升中含有的具有生物活性的病毒颗粒数。其他的VG/mL,VP/mL 都是所有病毒颗粒数,死的活的都算上,一片虚假繁荣,请自由玩儿去!慢病毒活性滴度怎么标定最准?绝对定量!绝对定量!绝对定量!又绝对又定量的方法,准到不要不要的!再说了,这「绝对定量」是医疗级病毒产品的公认滴度检测方法,诺华、Juno,这些 CarT 大佬们都用!不准?不准的话 FDA 能认吗?复杂又昂贵的方法,为了准,咱们忍啦!标准品检定绘制标准曲线,精确定量病毒基因组DNA 拷贝数。测定插入细胞基因组的 5'LTR—3'LTR 病毒基因组拷贝数。工具细胞 293T 基因组中的病毒特征单拷贝基因 A 和宿主特征单拷贝基因 B。TU=undefinedC/V=(初始细胞/感染病毒体积)×(2×A 基因拷贝/B 基因拷贝),计算感染效率。不要反转录,不要受 RNA 降解或反转录效率影响。如果病毒有荧光或者抗性,再结合表型联合判断。慢病毒滴度标那么准,有用吗?为啥细胞用慢病毒
转染是否成功的影响因素很多,如需要转染的细胞类型(对于困难的细胞系尤其如此),需要被转染的分子(DNA、RNA、寡核苷酸、蛋白质),转染试剂等。但无论在何种情况下,转染的成功均取决于转染效率、低细胞毒性以及重现性这几个要素。细胞分裂细胞相比较非分裂细胞——分裂细胞往往要比静止细胞更易于摄取并表达外源 DNA。因此对大多数转染操作而言,细胞都在转染当天或前一天种板。同样重要的是细胞在种板进行转染时不应处于过度生长的状态;此外,还常用促有丝分裂刺激物(如,病毒转化,生长因子,条件培养基,以及滋养细胞)来活化原代培养细胞。贴壁细胞相比较悬浮细胞——在转染效率方面贴壁细胞和悬浮细胞之间的差异显著。相对于贴壁细胞(如 HEK,CHO),悬浮细胞(如 HL 60,Jurkat)非常难以转染,可能是因为细胞间膜结构的差异,但目前还没有分子水平上合理机制的解释。分板方案——在对培养细胞进行分板传代培养之前,必须把贴壁细胞用胰蛋白酶消化使之脱离培养基质。这个常规操作可导致正常细胞功能受到严重损害。因此分批方案的不同(如,胰蛋白酶消化时间的长短,胰蛋白酶的灭活等)需要优化。传代次数——传代次数是指对一个细
慢病毒(Lentiviral,LV)可将外源基因有效地整合到宿主染色体上,从而实现持久性表达,这一特性使其在科研与临床治疗(CART)中大放异彩。但在临床治疗中,外源基因的整合会带来插入突变的风险。这种情形下,研究者开始拓展非整合慢病毒的可能性。IDLV(Integration-deficient Lentiviral) 即整合缺陷型慢病毒,是通过在慢病毒整合酶中引入突变产生的非整合型慢病毒,「不整合」的特性使其更适合于静息细胞、临床治疗、干细胞研究等场景使用。与其他载体相比,其优势为:此外,IDLV 可在分裂细胞中瞬时表达,非分裂细胞中稳定表达;并且可与任何慢病毒载体配套使用,产生非整合型的慢病毒。IDLV 的应用场景IDLV 在应用中有什么优势呢?适用于哪些研究呢? IDLV-CRISPR / Cas9高精准地进行基因编辑CRISPR / Cas9 是基因组编辑领域的明星技术,目前慢病毒载体(LV)是递送 CRISPR / Cas9 组分的重要手段,LV 可容纳大的 DNA 载荷并有效转导分裂和非分裂细胞,适用于绝大多数的科学研究。然而,持续表达的 CRISPR / Cas9 可能
腺相关病毒(AAV)作为一种安全、持久、高效、高特异性的基因操作工具,在生物学特别是神经生物学领域中被广泛使用。许多新手对于 AAV 的使用往往是知其然而不知其所以然。这篇短文将以图文结合的形式争取让大家在最短的时间内全面了解这种病毒工具。什么是AAV?野生型AAV 是一种复制缺陷型微小病毒,需要腺病毒或疱疹病毒帮助其在体内复制扩增。而我们做实验用的是不需要辅助病毒的重组 AAV 病毒(rAAV)。将目的基因的 CDS 区序列或者 RNAi 干扰序列插入 rAAV 表达质粒中,包装病毒,然后直接使用 rAAV 感染细胞就能完成目的基因操作。什么时候用rAAV?当我们需要对特定基因进行过表达或干扰时,特别是做动物实验的时候,就可以使用rAAV 病毒。针对不同的实验需求,下表可以帮助您选择合适的病毒工具。rAAV 的优点是什么?安全性高:目前还没有发现AAV 对人体致病;每 10 个人中就有 8 个人在一生中会感染AAV,而rAAV更是去除了96% 的 AAV 基因组,进一步确保了安全性。目前唯一通过欧盟药监局的基因治疗药物 Glybera 也是一种 rAAV。免疫原性低:当AAV 用局部
一、慢病毒包装简介及其用途慢病毒(Lentivirus)载体是以HIV-1 (人类免疫缺陷 I 型病毒)为基础发展起来的基因治疗载体。区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。慢病毒载体的研究发展得很快,研究的也非常深入。该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的基因治疗效果,在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景。目前慢病毒也被广泛地应用于表达RNAi 的研究中。由于有些类型细胞脂质体转染效果差,转移到细胞内的 siRNA 半衰期短,体外合成 siRNA 对基因表达的抑制作用通常是短暂的,因而使其应用受到较大的限制。采用事先在体外构建能够表达 siRNA 的载体,然后转移到细胞内转录 siRNA 的策略,不但使脂质体有效转染的细胞种类增加,而且对基因表达抑制效果也不逊色于体外合成 siRNA ,在长期稳定表达载体的细胞中,甚至可以发挥长期阻断基因表达的作用。在所构建的 siRNA 表达载体中,是由 R
一般情况下,瞬时转染是将 DNA 导入真核细胞的方式之一。在瞬时转染中,重组 DNA 导入感染性强的细胞系以获得目的基因暂时但高水平的表达。转染的 DNA 不必整合到宿主染色体,可在比稳定转染较短时间内(最多一周左右)收获转染的细胞,并对溶解产物中目的基因的表达进行检测。如果过表达基因用质粒,如果敲降用的是 siRNA(在 microRNA 实验中,过表达用的是 mimics,敲降用的是 inhibitor)。通过瞬时转染,将目的基因敲降或者过表达(gain and loss 实验),观察下游靶基因的表达情况,或者细胞表型(phenotype)的变化,例如凋亡,周期,增殖,侵袭,转移等。那该怎么做呢?一、准备lipofectamine2000(转染试剂)(避光),Opti-MEMI 减血清培养基(避光),目的基因的质粒或者 siRNA(以 siRNA 为例),细胞,六孔板,培养基,以及一些细胞实验所需的普通物品。二、步骤细胞接种:转染实验前天接种细胞,各种细胞的平板密度依据各种细胞的生长率和细胞形状而定。进行转染当天细胞密度应达到 60%~80% 覆盖。细胞转染:一般六孔板液体每孔在
陈玲玲研究组长期致力于 lncRNA 代谢与功能的研究。前期通过 non-poly(A) 测序发现一类新型 lncRNA 家族,它们来自内含子,两端以 snoRNA 结尾,研究人员将其命名为 sno-lncRNA。SLERT 是其中一个 sno-lncRNA,完全定位在细胞核仁。核仁是细胞核内一个复杂且高度动态变化的无膜亚结构,是细胞核内核糖体 RNA(rRNA)的加工厂。它在调节 rRNA 的转录、加工以及核糖体亚基组装中发挥着重要作用。核仁在形态上由内而外可以分为三层结构:多个纤维中心(Fibrillar Center,FC)和致密纤维组分(Dense Fibrillar Component, DFC)形成球状结构镶嵌在颗粒区(Granular Component,GC)内。之前的研究表明 SLERT 直接结合核仁蛋白 DDX21 并调控其形成的环状结构的大小进而促进 RNA 聚合酶 I 转录。RNA 聚合酶 I 转录复合物聚集在 FC 区域边缘对核糖体 DNA(rDNA)进行转录;rRNA 前体(pre-rRNA)加工蛋白质在 DFC 区域参与调控 rRNA 前体的定向转运和核仁
当谈到氧气时,我们常常想到氧气的好处,以及缺氧的危害。但如果呼吸比地球大气中通常的含氧量(21%)更高的空气,会导致人和动物的器官损伤、癫痫发作,甚至死亡,尤其是当它超过身体的氧气需求时。例如,最近的研究表明,呼吸过多的补充氧气可能对心脏病患者和早产儿有害。同样,在阻塞性睡眠呼吸暂停中,呼吸暂停后突然增多的氧气已被证明是该疾病如何增加患者慢性健康问题风险的关键原因。尽管如此,这些效应的机制仍然模糊不清。许多研究人员认为活性氧——具有较高反应活性的氧的代谢产物或衍生物,可能在高氧条件中发挥作用,破坏我们的基因组和我们细胞中的许多分子,但几乎没有证据表明过量的氧气如何影响特定的酶和途径。今日,格莱斯顿研究所的研究团队发表在Molecular Cell上的一篇研究Oxygen Toxicity Causes Cyclic Damage by Destabilizing Specific Fe-S Cluster-Containing Protein Complexes,发现了过量的氧气如何改变我们细胞中含有铁和硫的少数蛋白质——这是一种类似于铁生锈的化学过程。反过来,这些 「生锈」的蛋白质会
常言道,喝点小酒莫喝醉,少点熬夜早点睡,尽力活到 100 岁。为个人健康着想,喝酒应适量且节制,但生活中难免有人喝得酩酊大醉,甚至喝酒误事,酒后失态,给自己和他人带来无穷无尽的麻烦。成熟水果和花蜜中单糖自然发酵产生的乙醇消耗会导致中毒,损害活动能力和判断力,因此食用果糖和其他单糖的动物已经进化出肝酶来分解乙醇。在最新的研究中,研究人员又发现了一种新的醒酒分子——成纤维细胞生长因子 21(FGF21)。2023 年 3 月 7 日,德州大学西南医学中心Steven A. Kliewer团队在CellMetabolism杂志发表研究论文FGF21 counteracts alcohol intoxication by activatingthe noradrenergic nervous system,发现一种名为 FGF21 的激素可以保护小鼠免受醉酒引起的平衡丧失和纠正反射。利用 FGF21 给药进一步加速了醉酒后的恢复,FGF21 通过激活去甲肾上腺素能神经系统来发挥其清醒作用和警觉性,进而抵消酒精中毒等负面影响。图 1 来源:CellMetabolism研究内容FGF21 是一种由
据中国人口数据老龄化分析,截至 2021 年底,全国 65 岁及以上人口已突破 2 亿,比上年增加 334 万人,占总人口的 14.2%。人口老龄化是全球性问题,为了改善老年人群的生活质量和福祉,「积极老龄化」概念正在盛行。人类作为群居动物,社交环境深刻着生活的满意度和幸福感。既往已有大量研究表明,社交活动有助于老年人群的身心健康,但这些研究大多在西方人群中开展,而对于亚洲老年人参与社会活动与健康结果之间的关联,人们知之甚少。为了填补这一知识空白,四川大学华西医院的何森团队探索了社交频率与中国老年人群体的总体生存的关联,并以Association between social activity frequency and overall survival in older people: results from the Chinese Longitudinal Healthy Longevity Survey为题发表在 BMJ 子刊Journal of Epidemiology & Community Health上。该研究重点探讨了社交活动频率与中国老年人群寿命的关系,发现
适应性产热是指棕色脂肪组织和米色脂肪细胞响应外部刺激(例如寒冷暴露和运动等)产生热量【1】。由于其具有增加能量消耗的巨大能力,激活机体适应性产热已成为对抗全球肥胖及其相关疾病(如 2 型糖尿病和胰岛素抵抗等)的重要策略。研究表明交感神经元能通过释放儿茶酚胺激活脂肪细胞的产热程序【2】。然而,产热脂肪细胞反向调控交感神经投射的潜在机制并不清楚,因此无法建立起其相互作用的调控网络。2023 年 3 月 6 日,上海同济大学医学院、同济大学附属同济医院栾冰教授团队在Nature Metabolism杂志上发表题为Thermogenic adipocyte-derived Zinc promotes sympathetic innervation in male mice的研究成果。该研究报道了产热脂肪细胞可分泌锌离子作为脂肪因子激活交感神经的活性,进一步促进脂肪组织的适应性产热,为肥胖的治疗提供了新的理论基础。首先,研究人员使用白喉毒素清除脂肪组织中的 UCP1 阳性产热脂肪细胞后发现,交感神经对脂肪组织的支配程度大幅下降,这表明产热细胞能够促进交感神经轴突生长。为进一步揭示产热细胞调控交感
本周学术君继续带来 CNS 最新进展,助力大家勇攀科研高峰。1.Nature:揭示生命演化动力遗传突变率大小影响着物种长远的演化能力。2023 年 3 月 1 日,浙江大学的张国捷团队在Nature杂志发表研究论文Evolution of the germline mutation rate across vertebrates。该研究通过跨物种的比较分析和调查物种间的生活史特征的差异对突变率,证明当物种有效种群规模越大,每一代新突变的产生速率就越低,揭示了不同物种胚系突变率差异的根本原因和演化规律。图 1:来源Nature2.Science:USB1 能够修饰 miRNA 来调控造血发育USB1 介导的嗜中性白血球减少症(PN)是一种奇异的皮癣常染色体隐性骨髓衰竭(BMF)综合征,其机制不明。2023 年 3 月 3 日,美国华盛顿大学的Luis Francisco Zirnberger Batista联合科罗拉多大学博尔德分校的Andre Levchenko教授在Science杂志发表研究论文USB1 is a miRNA deadenylase that regulates he
既往有研究表明,睡眠规律性或与心血管疾病发生相关,但睡眠规律是否与动脉粥样硬化之间存在关联尚且缺乏相关研究。近日,《美国心脏协会杂志》有研究表明,睡眠不规律会增加动脉粥样硬化的患病风险。动脉粥样硬化表现为脂肪沉积物在动脉壁上堆积,继而导致动脉变窄和血流量减少,影响氧气和其他营养物质到达身体各处;严重情况下甚至会形成阻塞动脉的血块,继而引发冠心病、心肌梗死和心源性猝死等高风险疾病。2023 年 2 月 15 日,一项题为Sleep Irregularity and Subclinical Markers of Cardiovascular Disease: The Multi-Ethnic Study of Atherosclerosis的新研究发表在《美国心脏协会杂志》(JAHA)上,研究发现,与睡眠习惯更规律的人群相比,睡眠不规律者罹患动脉粥样硬化的风险更高(图 1)。图 1 JAHA 研究(图源:[1])这项动脉粥样硬化多种族研究(Multi- Ethnic Study of Atherosclerosis, MESA)共从美国六个大型社区招募 2032 位成年人,平均年龄为 68
心血管疾病是全球的主要死因。2019 年,共有 1790 万人死于心血管疾病,占全球死亡总数的 31%。在心血管死亡事件中,85% 人群死于心脏病和中风。据多项研究表明,身体活动,尤其是中等强度运动,可降低心血管疾病和癌症的患病风险。英国国家医疗服务体系 NHS 曾建议,成年人每周应进行至少 150 分钟的中强度活动或 75 分钟的高强度活动。近日,有新研究表明,如果你坚持不了那么久,适度的中度运动也可达到保健预防的效果。2023 年 2 月 28 日,剑桥大学临床医学院在BritishJournalofSportsMedicine发表题为Non-occupational physical activity and risk of cardiovascular disease, cancer and mortality outcomes: a dose–response meta-analysis of large prospective studies的研究,他们发现适度运动可以降低早期死亡风险。具体而言,每天坚持 11 分钟的快步,便可显著降低心脏病、中风和癌症等患病风险。图 1
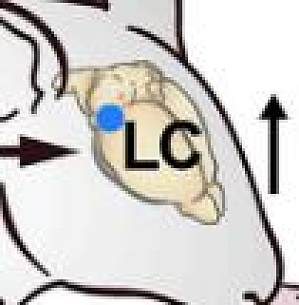
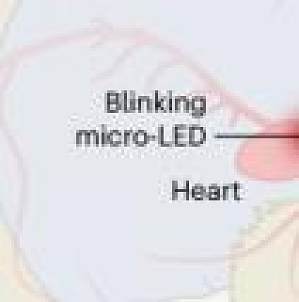
导读你是否曾经因为焦虑而感到心跳加速?这种心动过速是焦虑的主要症状之一,可能非常强烈,以至于患者有时会误以为是心脏病发作。前期的研究揭示了许多将信号从大脑传递到心脏的途径,但是心率是否会反过来对情绪造成影响这一问题,已经在临床精神病学和基础神经科学领域争论了近一个世纪。2023 年 3 月 2 日,来自斯坦福大学的研究团队在国际顶尖期刊Nature发表了题为Cardiogenic control of affective behavioural state的文章,在该研究中,他们证实心率增加与小鼠焦虑相关行为的增加有关,证明了来自身体的信号如何影响与焦虑和恐惧等情绪相关的情感行为。他们开发了一种非侵入性光遗传起搏器,能够在自由活动的小鼠中精确地针对特定细胞类型来控制心率,最高可达每分钟 900 次(基线心率为 660 次/分钟)。借助该技术,他们发现,心跳加速也会与大脑「对话」,导致与焦虑相关的行为,并精确定位了相关的大脑区域。图片来源:Nature主要研究内容无创光遗传的心脏节律控制首先,研究人员在小鼠心肌肌钙蛋白 T 启动子(mTNT)的控制下将 ChRmine 转染到基因组,以实