原理
首先在体外以长为 200~1000 bp 的 cDNA 为模板转录合成正义与反义的单链 RNA 分子,然后通过退火形成长的 dsRNA 分子,再用Diccr 核酸酶进行切割得到 siRNA 分子的混合物,通过纯化去除没有被切割的双链 RNA 分子和 DNA 模板以后,siRNA 分子就可以用于转染细胞。由于在混合液中含有大量的以目的基因不同位点为靶的 siRNA 分子,因此可以获得对靶基因的高效抑制效果。
材料与仪器
步骤
一、材料与设备
1. 合成的 DNA 寡核苷酸。
2. 靶基因 cDNA。
3. T7 RNA 体外转录试剂盒(Promega 公司)。
4. DNase Ⅰ 和单链特异性的 RNase。
5. 重组的 Dicer 酶。
6. 蛋白酶 K ( 0.2 mg/ml)。
7. 1X Dicer 反应缓冲液(250 mmol/L NaCl,30 mmol/L HEPES ( pH 8.0 ), 0.05 mmol/L EDTA,2.5 mmol/L MgCl2 )。
8. EDTA 10 mmol/L ( pH 8.0 )。
9. 水饱和酚。
10. 氯仿:异戊醇 ( 24 : 1 )。
11. 聚丙烯酰胺凝胶。
12. 电泳装置。
二、操作方法
1. 将靶基因 cDNA 片段按正反两个方向克隆到 T7 启动子的下游,并采用 T7 RNA 体外转录试剂盒转录合成互补的两条 RNA 链,两条 RNA 链在体外互补形成双链 RNA 分子,纯化后备用(具体的操作方法见体外转录合成 siRNA 分子)。
2. 在 1X Dicer 反应缓冲液中加入约 500 ng 纯化后的双链 RNA 和适量的 r-Dicer,在 37℃ 反应适当的时间后(通过预实验确定)加入 10 mmol/L EDTA 终止反应,经蛋白酶 K 处理后,采用酚:氯仿:异戊醇 ( 25 : 24 : 1 ) 抽提。如果是大量制备的话,其中的蛋白质与残留的长 dsRNA 应该通过凝胶纯化或通过柱层析纯化。
3. 纯化获得的 siRNA 分子混合物可以直接用于转染细胞,或置 -20°C 保存。siRNA 双链复合物可以经过几轮冻融而不受影响,不需要经过再次变性退火处理。但是在处理 siRNA 分子时,建议最好将 RNA 溶液置于冰浴中,以降低 RNA 水解的速率。
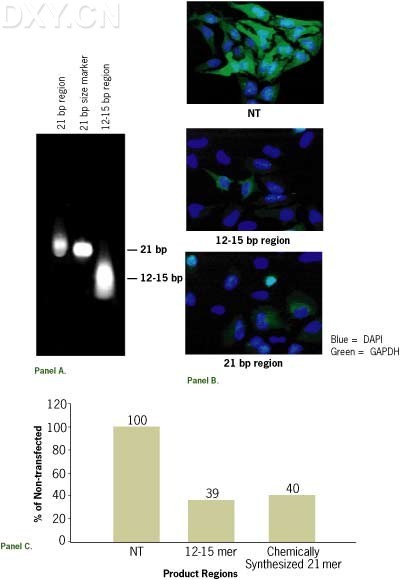
4. 为了确定获得的 siRNA 分子的大小,可以通过 18% 变性聚丙烯酰胺凝胶 ( PAGE ) 进行分离并用合成的单链 RNA 分子作为对照;也可以通过 15% 的非变性聚丙烯酰胺凝胶进行分离,分子量对照采用合成的双链 siRNA 分子。
1. 合成的 DNA 寡核苷酸。
2. 靶基因 cDNA。
3. T7 RNA 体外转录试剂盒(Promega 公司)。
4. DNase Ⅰ 和单链特异性的 RNase。
5. 重组的 Dicer 酶。
6. 蛋白酶 K ( 0.2 mg/ml)。
7. 1X Dicer 反应缓冲液(250 mmol/L NaCl,30 mmol/L HEPES ( pH 8.0 ), 0.05 mmol/L EDTA,2.5 mmol/L MgCl2 )。
8. EDTA 10 mmol/L ( pH 8.0 )。
9. 水饱和酚。
10. 氯仿:异戊醇 ( 24 : 1 )。
11. 聚丙烯酰胺凝胶。
12. 电泳装置。
二、操作方法
1. 将靶基因 cDNA 片段按正反两个方向克隆到 T7 启动子的下游,并采用 T7 RNA 体外转录试剂盒转录合成互补的两条 RNA 链,两条 RNA 链在体外互补形成双链 RNA 分子,纯化后备用(具体的操作方法见体外转录合成 siRNA 分子)。
2. 在 1X Dicer 反应缓冲液中加入约 500 ng 纯化后的双链 RNA 和适量的 r-Dicer,在 37℃ 反应适当的时间后(通过预实验确定)加入 10 mmol/L EDTA 终止反应,经蛋白酶 K 处理后,采用酚:氯仿:异戊醇 ( 25 : 24 : 1 ) 抽提。如果是大量制备的话,其中的蛋白质与残留的长 dsRNA 应该通过凝胶纯化或通过柱层析纯化。
3. 纯化获得的 siRNA 分子混合物可以直接用于转染细胞,或置 -20°C 保存。siRNA 双链复合物可以经过几轮冻融而不受影响,不需要经过再次变性退火处理。但是在处理 siRNA 分子时,建议最好将 RNA 溶液置于冰浴中,以降低 RNA 水解的速率。
4. 为了确定获得的 siRNA 分子的大小,可以通过 18% 变性聚丙烯酰胺凝胶 ( PAGE ) 进行分离并用合成的单链 RNA 分子作为对照;也可以通过 15% 的非变性聚丙烯酰胺凝胶进行分离,分子量对照采用合成的双链 siRNA 分子。
来源:丁香实验