相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 提供商:
威斯腾
- 服务名称:
牛视网膜/小鼠脑微血管内皮细胞
威斯腾生物经过10多年的发展,获得了上百种细胞株和四十余种原代细胞培养经验,并建立了庞大的细胞库及原代培养资料库。细胞平台有资深实验员、规范的SOP操作文件,万级净化细胞房,这些条件为保质保量完成每个客户的实验提供了保障。 同时,威斯腾生物结合多年原代及传代细胞培养经验,结合平台已有的技术优势,建立了完善的体外药筛实验,并引进RTCA(Real-time cellular Analysis,实时无标记细胞记录仪),在药筛过程中,全程实时记录细胞真实状况,为药筛提供最真实精准的实验数据。
无菌操作注意事项
细胞培养一定要保持工作区的无菌清洁,先用紫外灯和臭氧杀菌1h,然后通风30min,操作前需要换细胞间专用拖鞋,双手带上一次性橡胶手套并用75%乙醇消毒,穿上实验服,戴上一次性口罩和帽子,操作时不能大声说话,整个无菌操作都应该在酒精灯的周围进行。
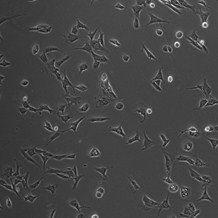
牛视网膜血管内皮细胞
(1)取成牛眼球,75%酒精消毒,取出周围多余组织,用PBS洗3次,用PBS流水冲洗眼球3次。
(2)沿角膜缘剪开眼球,弃掉角膜、晶体、玻璃体等部分,将眼球后半部翻转取出视网膜,将其剪碎平皿内加入适量0.25%的胰酶,在37℃培养箱中,采用分次消化,每次消化20min约8次。
(3)每次消化后取上清液,并加入等量的含10%的DMEM培养基,轻轻混匀,中和胰酶的消化,防止消化过度。用200目细胞过滤筛子过滤含细胞的混合液,最后将过滤后的细胞悬液1000rpm离心5min。离心后收集沉淀,用PBS再次重复离心3次。用细胞培养基将细胞沉淀重悬,接种于细胞培养瓶中培养,并每日观察细胞的生长,接种后约4d后有少量细胞贴壁。

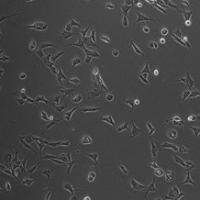
小鼠脑微血管内皮细胞分离
1.C57小鼠颈椎脱臼处死后浸泡于75%乙醇中消毒3~5 min后断头置于玻璃培养皿中,打开颅腔后取出全脑置于盛有冷D-Hanks'液的玻璃培养皿中解剖去除小脑、间脑(包括海马)。
2. 随后将大脑半球在干滤纸上缓慢滚动以吸除软脑膜及脑膜大血管后置于新的含冷D-Hanks'液玻璃培养皿中,用细解剖镊去除大脑白质、残余大血管和软脑膜,保留大脑皮质。
3. 用D-Hanks'液漂洗3次后,加入1 ml DMEM培养液,用虹膜剪将其剪碎成1 mm3大小,加入0.1%Ⅱ型胶原酶(含30 U/ml DNase I,1 ml/大脑)混匀后37 ℃水浴消化1.5 h。
4. 离心(1 000 rpm,5 min,室温),去上清液,加入20% BSA悬浮混匀后离心(1000 g,20 min,4 ℃),去除中上层神经组织及大血管,保留底部沉淀。
5. 加入3 ml 2.5%胰酶消化液消化20min,加入等量含血清培养基终止消化,离心(1 000 rpm,8 min,室温),去上清液,加入2 ml DMEM培养液悬浮后铺于经离心形成连续梯度的12 ml 50% Percoll(25 000 g,60 min,4 ℃)。
6. 离心(1 000 g,10 min,4 ℃),靠近底部的红细胞层之上的白黄色的层面即为纯化的微血管段,吸出后用DMEM漂洗两次(离心1 000 rpm,5 min,室温),去上清液。
7. 加入DMEM完全培养液(含20% FBS)悬浮后接种于涂布基质的35 mm一次性塑料培养皿(1.5 ml/培养皿,可接种1个培养皿/大脑),置于37 ℃、5%CO2培养箱内静置培养,12~24 h后换液,并加入1 ng/ml bFGF,随后隔天换液。
细胞形态
脑微血管内皮细胞原代培养过程中,约24h即可贴壁生长,细胞呈长梭形生长缓慢。换液后细胞增殖明显,出现以梭形为主的多种形态,5- 7d 70%-80%可融合达到传代标准。

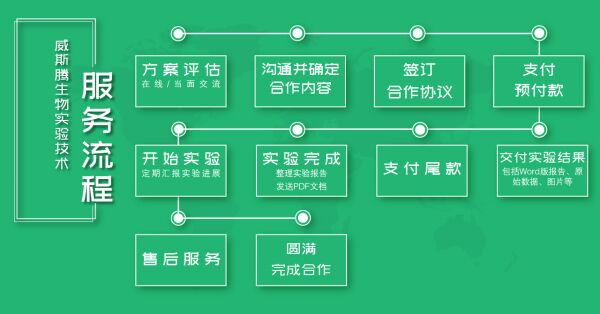
威斯腾实验服务流程
威斯腾生物服务项目
| 细胞生物学检测 | 高通量测序 | 代谢组学 |
| 细胞原代培养 | mRNA测序 | 气相色谱GC/MS |
| MTT检测 | LncRNA测序 | 液相色谱LC/MS |
| 细胞凋亡检测 | 全基因组测序 | 核磁共震NMR |
| 细胞周期检测 | RNA-Seq测序 | |
| 细胞克隆形成实验 | 外显子测序 | 影像学相关实验 |
| Transwell细胞迁移/侵袭 | 16s扩增子测序 | Micro-CT |
| 流式分选 | Small RNA测序 | 小动物活体成像 |
| CCK8/XTT检测 | 宏基因组测序 | 核磁共振 |
| 台盼蓝检测细胞活性 | 单细胞测序 | PET-CT |
| 药物筛选细胞学实验 | circleRNA测序 | |
| 细胞粘附性检测 | 甲基化测序 | 基因编辑动物 |
| 细胞划痕实验 | 条件性敲除小鼠/大鼠 | |
| 细胞生物学整体实验 | 全基因敲除小鼠/大鼠 | |
| 细胞成管实验 | ||
| 病理检测 | CRISPR/Cas9细胞敲除/敲入 | 基因芯片 |
| 扫描电镜 | 基因定点突变细胞系 | LncRNA芯片 |
| 透射电镜 | 单基因敲除细胞系 | miRNA芯片 |
| HE染色 | 多基因敲除细胞系 | mRNA芯片 |
| 免疫组化 | 目的基因敲入细胞系 | 甲基化芯片(限人和小鼠来源样本) |
| Tunel(原位末端凋亡法)检测 | 报告基因敲入细胞系 | SNP芯片(限人和小鼠来源样本) |
| 激光共聚焦 | miRNA/LncRNA敲除细胞系 | |
| 免疫荧光 | ||
| Masson染色 | CRISPR/Cas9动物敲除/敲入 | 科研设计指导&文章评估/润色 |
| 原位杂交 | 基因敲除大鼠/小鼠 | 科研文献论著翻译 |
| 荧光原位杂交 | 基因敲入大鼠/小鼠 | 论文翻译润色服务 |
| 特殊染色(PSA、茜素红、阿尔新蓝等) | 临床实验/科研实验设计方案指导 | |
| 行为学检测 | 药物筛选服务项目 | 药效学评价 |
| 旷场实验 | 高通量自动药物筛选平台 | 抗肿瘤药物药效学评价 |
| 重复性刻板行为检测 | 细胞高内涵药物筛选平台 | 心血管系统药物药效学评价 |
| 动物跑台检测 | 蛋白质组学靶标研发平台 | 泌尿系统药物药效学评价 |
| 强迫游泳 | 分子药理研究平台 | 内分泌系统药物药效学评价 |
| 生物膜片钳药物筛选平台 | 抗炎免疫药物药效学评价 | |
| 常规药物体外筛选 |
【本平台合作项目】
分子生物学、细胞生物学、基因敲出/入、模式动物、SPF动物保种、病理学检测、免疫学检测、影像学检测、原代培养、细胞药筛、CRISPR/Cas9基因编辑、基因芯片、高通量测序、蛋白组学、代谢组学、高通量高内涵筛选、药效学评价、药理毒理学实验、慢病毒包装与稳转株建立、SiRNA与纳米载药、ChIP、CO-IP、生物信息学分析、知识产权服务!
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验摘要: 目的 探讨脑微血管内皮细胞的体外培养方法并进行细胞超微结构研究及组织型纤溶酶原激活物(TPA ) 活性测定。 方法 取新生小鼠脑组织, 通过匀浆、过筛、胶原酶消化、差速粘附等技术对鼠脑微血管内皮细胞进行原代培养, 待细胞铺满瓶底时, 用01125%胰酶20102%EDTA 消化, 离心收集内皮细胞, 进行传代培养。原代、传代各取8 例, 吸取培养液用酶联免疫吸附试验测试TPA 活性。 结果 经Ð 因子相关抗原免疫组织化学鉴定、细胞超微结构观察, 证明培养的是血管内皮细胞。培养
pengchen628 各位前辈现有一个问题请教。 我是将Tie2/LacZ小鼠的骨髓单个核细胞移植到FVB小鼠身上,现在骨髓移植已经成功。我想鉴定FVB小鼠身上是否有LacZ基因,应该采取什么方法? 注:转基因的Tie2/lacZ小鼠可以在内皮细胞专有启动因子Tie2的转录调控下持续表达β-半乳糖苷酶,可与X-gal染色成蓝色,被广泛用于细胞谱系分析。 十分感谢! wbald 你都已经说了,X-gal
CD11a/CD11b/CD11c 分子 CDlla 常用单克隆抗体或代号:MHM24, 2F12; CRIS―3(LFA―lα链,整合素α1) 主要表达细胞:Leu[A5] 分子质量(kDa)和结构:spl80(整合素α) 功 能:与1CAM-l(CD54)、ICAM-2(CDl02)、ICAM-3(C1350)结合,介导细胞黏附;与JAMl结合,参与白细胞穿过内皮细胞
 技术资料
技术资料暂无技术资料 索取技术资料