相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 英文名:
KAPA Library Amplification Kit with Primers (50 x 50 µl reactions)
- 规格:
(50 x 50 µl reactions)
在PCR扩增过程中,DNA扩增酶对文库中的不同DNA片段的扩增效率不完全一样。而非均匀的扩增所有的基因片段。这种扩增偏好性会加剧测序覆盖度的不均衡性。KAPA HIFI文库扩增试剂是为了应对由PCR扩增产生的偏好性问题。试剂盒中含有的新型KAPA HIFI DNA扩增酶,是二代基因工程酶,具有高保真性,高眼神能力,对于复杂DNA模板展示出均衡的扩增效率。
,产品应用
高效,高保真,低偏好,扩增测序前的文库,主要包括:
1,全基因组鸟枪法测序。
2,靶标测序(补货前/后扩增)
3,扩增子测序
4,CHIP测序
5,RNA测序
技术优势:
1,提高基因组中GC或高AT区的扩增效率
2,降低扩增偏好性从而提高测序覆盖度。
3,具有行业领先的工业级保真性。
3、优异表现
(1)高GC含量对于使用普通具有校正功能(proof-reading) (B-家族)扩增酶扩增的文库在测序读深中的影响
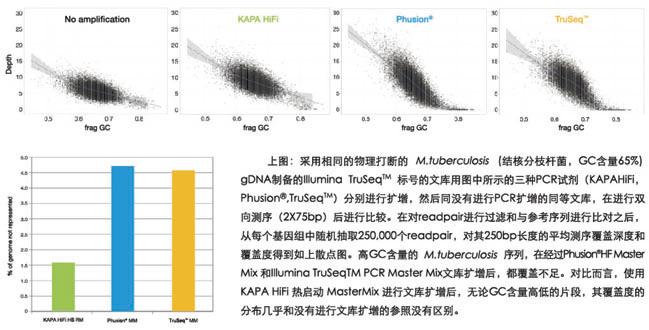
(2)根据文库扩增所用的扩增酶的不同,低GC含量的文库会产生不同的扩增偏好性
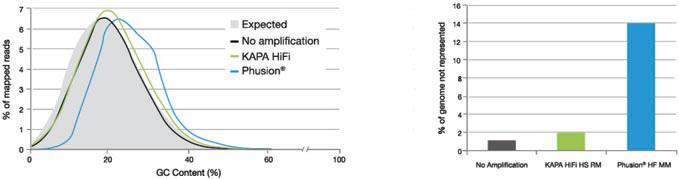
上图:采用相同的物理打断的 P.falciparum(恶性疟原虫,AT含量65%)gDNA制备的文库用图中所示的PCR试剂(KAPA HiFi,Phusion®)分别进行扩增,然后与没有进行扩增的同等文库进行比较。不同条件下测序read的观察到的不同GC含量的频率如图中曲线所示(黑色=没有扩增;绿色=KAPA HiFi热启动Master Mix;蓝色=Phusion® HF Master Mix)。Reads的期望频率分布为图中灰色阴影区域。未经扩增的文库曲线基本与期望频率分布区域外缘重合。使用KAPAHiFi作为扩增的文库表现出最小的偏差,而使用Phusion®进行扩增的文库中高GC含量的片段,和低GC含量的片段相比,表现出巨大扩增偏差。各文库平均覆盖深度为16.0X(作为对照的未扩增样本);16.5X(KAPA HiFi);18.8X(Phusion®)。以上数据由The Wellcome Trust Sanger Institute,Dr.Michael A.Quail提供。
(3)文库扩增会极大影响测序覆盖度的一致性
以下在Artemis的截屏图像描绘了分别使用KAPA HiFi热启动Master Mix、Phusion® HF Master Mix进行文库扩增后,与未进行文库扩增的对照相比,出现的覆盖度偏差。经过上诉不同的扩增途径,无论是高GC含量还是低GC含量的片段,覆盖度偏差的程度也有不同。
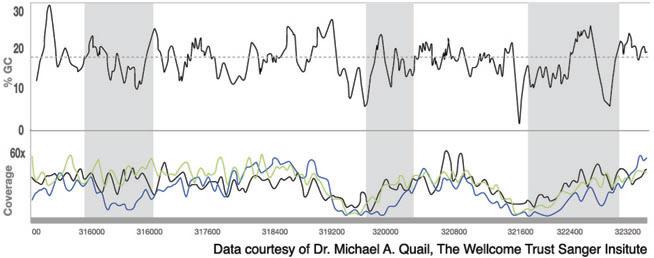
上图:P.falciparum(恶性疟原虫)基因组中一7kb片段的覆盖深度和GC含量
在这段基因组序列中,有3处AT含量>80%,从而导致覆盖度偏差(灰色标注区域)。在这三处高AT区域中,使用PHusion®(蓝色)进行文库扩增后,覆盖深度急剧下降;而使用KAPA HiFi(绿色)进行文库扩增后,三处区域覆盖深度与基因组其他区域统一、一致,而且与没有进行扩增的对照组的覆盖深度结果基本重合。
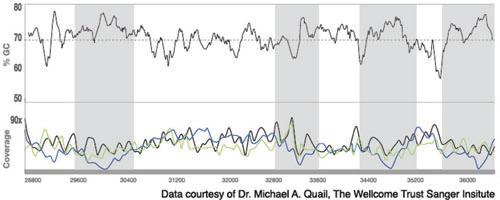
上图:B.pertussis(百日咳鲍特菌)基因组中一7kb片段的覆盖深度和GC含量
在这段基因组片段中,有4处GC含量>75%,从而导致覆盖度偏差(灰色标注区域)。在这4处高GC含量区域中,使用PHusion®(蓝色)进行文库扩增后,覆盖深度和未进行扩增的对照相比,急剧下降;而使用KAPA HiFi(绿色)进行文库扩增后,4处区域覆盖深度比较统一、一致,与没有进行扩增的对照组(黑色)的覆盖深度结果相似。
(4)高保真文库扩增的超高准确性
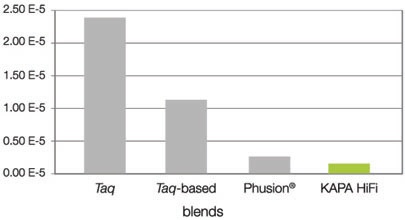
上图:DNA扩增酶(包括混合酶)的错误率KAPA HiFi扩增酶对的错误率/错配率是每覆盖3.54×106 碱基仅出现一个错误(2.82×10-7),错误率比Taq扩增酶低100倍,比基于Taq的混合酶低40倍,比Phusion®低2倍。
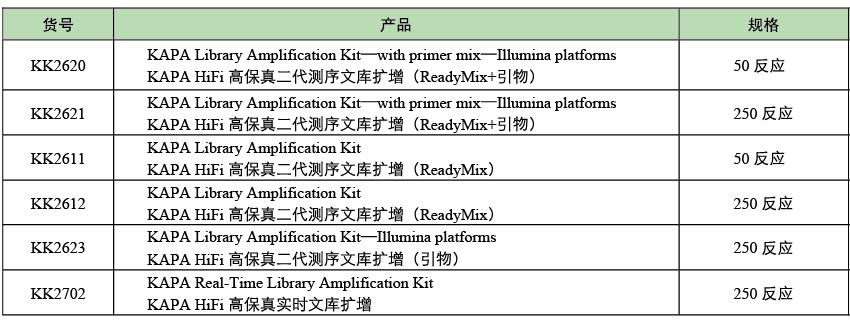
4、产品信息
| 二代测序文库制备 | KK8230 | KAPA LTP文库构建(含文库扩增)试剂盒-Illumina | 10个文库 | 2500 |
| KK8231 | KAPA LTP文库构建(不含文库扩增)试剂盒-Illumina | 10个文库 | 2400 | |
| KK8232 | KAPA LTP文库构建(含文库扩增)试剂盒-Illumina | 50个文库 | 11000 | |
| KK8233 | KAPA LTP文库构建(不含文库扩增)试剂盒-Illumina | 50个文库 | 10500 | |
| KK8234 | KAPA HTP文库构建(含文库扩增)试剂盒-Illumina | 96个文库 | 18000 | |
| KK8235 | KAPA HTP文库构建(不含文库扩增)试剂盒-Illumina | 96个文库 | 17000 | |
| KK8260 | KAPA TruSeq Adapter Kit, (Illumina, 20 μl each) | 144 rxn | 14000 | |
| KK2620 | KAPA Library Amplification Kit with Primers (50 x 50 µl reactions) | 50rxn | 1800 | |
| KK2621 | KAPA Library Amplification Kit with Primers (250 x 50 µl reactions) | 250rxn | 8000 | |
| KK2623 | KAPA Library Amplification Primer Kit (250 x 50 μl rxns) | 250rxn | 1500 | |
| KK8400 | KAPA Stranded RNA-Seq Library Preparation Kit (Illumina,24 reactions) | 24 rxn | 13000 | |
| KK8401 | KAPA Stranded RNA-Seq Library Preparation Kit (96 reactions) | 96 rxn | 40000 | |
| KK8420 | KAPA Stranded mRNA-Seq Library Preparation Kit (24 reactions) | 24 rxn | 15000 | |
| KK8421 | KAPA Stranded mRNA-Seq Library Preparation Kit (96 reactions) | 96 rxn | 47000 |
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验室,实现高通量的目的。再通过KAPA专利技术来筛选出具有特定功能(比如,快速,或者超强PCR)的DNA聚合酶。和体积庞大的机械手相比,该技术的筛选过程是在1ml小试管中完成。能够完成对文库中所有变异株的筛选(>108)。在这个基础上,经过几次循环,就可以得到具有特定功能的聚合酶。
含有这两种酶切位点序列。 已经开始进行ta克隆 如楼上战友所述,TA克隆的确是长片段亚克隆的好的手段。我最初开始学习构建质粒的时候也是先上TA,不过我们实验室一直使用一种KAPA HIFI readymix的酶,效果很好,保真性也非常非常高,就是做TA的时候比较麻烦,需要把PCR产物纯化回收后再加一次A tail,而就是这一步我感觉一直没有摸索到最优化稳定的条件,所以每次加A后连pCR2.1 转化的结果都不稳定,有时候长的多有时候长得少,之前曾经就这个问题发帖
列的质量评估工作,证明了提取环境样品DNA的过程中使用IRT技术的重要性。一篇总结性文章曾发表于ASM 2010年年会(可致电:0755-8348 9872索取)。使用含IRT技术的MO BIO PowerSoil® DNA Isolation Kit,与不含IRT技术的竞争品牌试剂盒,提取0.1g堆肥做对比试验。最终DNA用分光光度法和凝胶电泳分析作初步分析,然后用通用引物16S rRNA,KAPA2G Fast HotStartReadymix酶跑end-point PCR。下图(图3A)展示
 技术资料
技术资料暂无技术资料 索取技术资料










