相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 保存条件:
-80℃冻存
- 保质期:
二年
- 英文名:
HepG2-RHBV
- 库存:
20
- 供应商:
上海泽叶生物科技有限公司
- 规格:
1x10^6 cells
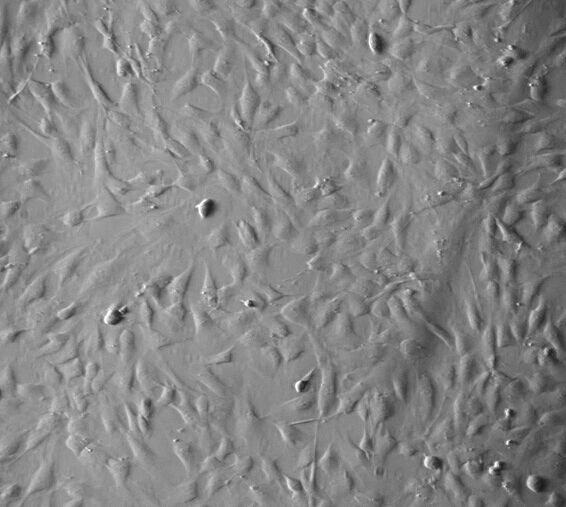
细胞英文(简称):HepG2-RHBV
细胞来源: ATCC DSMZ JCM ECACC
代次:P3
规格:T25
细胞数:1x10^6 cells
组织来源:肝
细胞形态:贴壁
细胞活力:95%(Viability by Trypan Blue Exclusion)
细胞检测:细胞不含有:HIV-1、HBV、HCV、支原体、细菌、酵母和真菌
培养条件:RPMI-1640 +10% FBS;37℃,5% CO2
传代方法建议:1:2-1:3 两天换液一次
冻存条件:完全培养基50%+40%FBS+10%DMSO
传代细胞培养操作步骤
1、 37度水浴加热所有试剂。
2、 吸取培养培养皿内旧培养液,放置一个干净离心管内。(为稍后终止消化作准备。)
3、 用PBS清洗培养皿,弃去。
4、 向瓶内加入消化液(胰蛋白酶液)。以能覆盖培养瓶底为宜。(一般一个大皿1ml)
5、 2-5分钟后,轻轻震荡培养皿。使HepG2-RHBV人肝癌细胞株从瓶壁脱离形成细胞悬液。显微镜下观察若细胞由贴壁变为悬浮就加入血清(即原培养液)终止消化。
6、 收集细胞悬液,880转/分、5分钟离心,弃去上清液。
7、 加培养液至1ml,混匀后取10ul计数细胞。
8、 根据实验要求取适量细胞留种或接种于新的培养皿或96孔板、24孔板中,再加入相应体积的培养液。(90mm大皿是9ml,中皿好像是4mm,6孔板和小皿是2ml,96孔板是100ul)。
9、 接种好的培养皿顺时针和逆时针各转三圈,使细胞排列均匀。
10、 放入暖箱中继续培养。
细胞计数步骤:
1、将计数板及盖片擦拭干净,并将盖片盖在计数板上.
2、将细胞悬液吸出少许,用台盼兰溶液对被稀释后滴加在盖片边缘,使悬液充满盖片和计数板之间。(台盼兰用于标记死亡细胞。)
3、镜下观察,计算计数板八大格细胞总数,压线细胞只计左侧和上方的。然后按下式计算:
细胞数/ml=8大格细胞总数/ 8×2×10000
细胞冻存与复苏:
HepG2-RHBV人肝癌细胞株冻存和复苏的原则:慢冻快融
当细胞冷到零度以下,可以产生以下变化:细胞器脱水,细胞中可溶性物质浓度升高,并在细胞内形成冰晶。
如果缓慢冷冻,可使细胞逐步脱水,细胞内不致产生大的冰晶;相反,结晶很大,大结晶会造成细胞膜、细胞器的损伤和破裂。复苏过程应快融,目的是防止小冰晶形成大冰晶,即冰晶的重结晶。
1.冻存细胞
(1)选对数增生期细胞,在冻存前1d换液。
(2)按常规方法把培养细胞制备成悬液,计数,使细胞密度达5×106/m1左右密度,离心,去上清。
(3)加入配制好的冻存液(培养液6.8ml,小牛血清2ml,DMSO 1ml,5.6%NaHCO3 0.1ml),按与去上清相同的量一滴一滴加入离心管中,然后用吸管轻轻吹打令细胞成再悬液。冻存细胞时培养液中加入保护剂10%二甲基亚砜(DMSO) 或甘油,它是一种渗透性保护剂,可迅速透入细胞,提高胞膜对水的通透性,降低冰点,延缓冻结过程,能使细胞内水分在冻结前透出细胞外,在胞外形成冰晶,减少胞内冰晶,从而减少冰晶对细胞的损伤
(4)分装于无菌冻存管中,每管加1.5m1悬液。
(5)旋好冻存管并仔细检查,一定要盖紧,作好标记。
(6)冻存:在特殊的仪器或简易的液氮容器中,按-1℃/min的速度,在30~40 min时间内,下降到液氮表面,再停30 min后,直接投入液氮中。要适当掌握下降冷冻速度,过快能影响细胞内水分透出,太慢则促进冰晶形成。
标准程序:
当温度在-25℃以上时, 1~2℃/min
当温度达-25℃以下时, 5~10℃/min
当温度达-100℃时,可迅速放入液氮中
简易程序:
将冷冻管(管口要朝上)放入纱布袋内,纱布袋系以线绳,通过线绳将纱布袋固定于液氮罐罐口,按每分钟温度下降1~2℃的速度,在40分钟内降至液氮表面,停30分钟后,直接投人液氮中。
操作时应戴防护眼镜和手套,以免液氮冻伤。
2. 复苏细胞
(1)从罐中取出冻存管。
(2)迅速放入37℃水浴,不时摇动,使其急速融化,30~60s内完成。
(3)冻存管用70%酒精擦拭消毒后,打开盖子,用吸管将细胞悬液注入离心管中,再滴加10 m1培养液。
(4)HepG2-RHBV人肝癌细胞株低速离心(880r/min) 5 min,去上清后再用培养液洗一次。
(5)用培养液适当稀释后,装入培养瓶37℃培养,次日更换一次培养液后,继续培养。以后仍按常规进行培养。
冻存细胞数量要充分,密度应达到107/m1,在融后稀释20倍后,仍能保持5×105/m1数量。
| 90031402 | FEA4 + PFSC/C1 | 91061232 | WM-115 | 94101901 | BW1J | 6061905 | HRA-16 | 85042502 | MRC-5 SV1 TG2 |
| 90031403 | Clone 81 | 91061233 | WM 266-4 | 94101904 | FGC4 | 6092001 | H103 | 85050301 | H9 |
| 90031532 | BUD-8 | 91061307 | AKR-2B | 94101905 | H5 | 6092003 | H314 | 85050302 | CHO |
| 90031901 | MSV.B | 91062702 | RAW 264.7 | 94101906 | C2 | 6092005 | H376 | 85051003 | U266B1 |
| 90031902 | MSVIF-TK+ | 91070510 | MS | 94101907 | C2-Rev 7 | 6092006 | H400 | 85051004 | INT 407(HeLa derivative) |
| 90032006 | HCT-8 | 91072201 | HT29 | 94101908 | HF1 | 94072247 | LC-2/ad | 85051005 | CHO-K1 |
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验wj1989113 最近一直在做慢病毒载体,用的是第二代的三质粒系统,目的片段是一个肝细胞的转录因子。载体构建好之后,包装了一批病毒。然后拿慢病毒感染肝癌细胞株3B和Huh7细胞,想通过PCR和Western验证病毒的表达情况。出现了一些问题: 1、每次拿慢病毒感染肝癌细胞株,荧光都很亮,但是做PCR或者Western之后,加对照病毒GFP组的细胞和目的病毒无差异。(条带都较亮)尤其是Western,几乎没有差异。 2、感染
恶性肿瘤的主要生物学特性之一是转移性,建立与临床表现相近的动物模型是研究的关键环节。人体肿瘤移植于裸小鼠建立人癌异种移植动物模型为深入研究提供了可能。原位移植可为人体肿瘤生长提供相似的微环境,更利于肿瘤恶性行为的表现,因此,大多采用原位移植的方法建立肿瘤转移动物模型。 根据我们多年的肿瘤模型构建经验,为大家介绍几种我们常遇到的几种肿瘤模型构建方法,以供参考。 一、人肝癌原位移植模型 将人肝癌细胞株(如:HepG2等)传代培养后,收集对数生长期的细胞制成
峨眉茶客 HepG2、Eca-109、L0V0各是什么细胞?初学者不懂,望各位GG、JJ赐教 freecell HepG2:人肝肿瘤细胞株 Eca-109:人食管癌细胞 LOVO细胞:人结肠腺癌细胞株 建议楼主养成google的习惯。 峨眉茶客 谢谢版主,我用百度搜了搜,没有收到。谢谢 gingivalis 百度虽然口碑
 技术资料
技术资料暂无技术资料 索取技术资料