相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 保质期:
Cellular Senescence Detection Kit - SPiDER-βGal
- 英文名:
Cellular Senescence Detection Kit - SPiDER-βGal
- 库存:
Cellular Senescence Detection Kit - SPiDER-βGal
- 供应商:
研卉生物
- 规格:
5assays (35mm dish)
细胞衰老检测试剂盒 - SPiDER-βGal
特点:
● 活细胞和固定细胞均可染色
● 可用共聚焦显微镜或流式细胞仪检测
● 可固定后与抗体共染色
常见问题Q&A
| Q1: 本试剂盒的大概可以检测多少次? |
| A1:大概的检测次数,请参考下表中不同的使用容器: |
| 35mm dish | Micro Plate | Chamber Slide | |
| 使用次数 | 5 dishes | 2 plates | 7 slides |
| *使用次数会随着每孔添加的染色溶液量的变化而变化。使用前请先确认每孔的必要的染色溶液量。 |
| Q2: 为什么要添加Bafilomycin A1? |
|
A2:很多细胞内部都存在内源性β-半乳糖苷酶 (β-galactosidase),由于SPiDER-βGal与内源性β-半乳糖苷酶和细胞衰老的标记物SA-β-Gal都会发生反应。即使在没有衰老的细胞中,背景也较高,妨碍了SA-β-Gal的检测。 Bafilomycin A1可以抑制溶酶体中的ATPase活性,并将溶酶体中的pH从酸性变为接近中性,从而降低了内源性β-半乳糖苷酶的活性。因此,在添加SPiDER-βGal之前先用Bafilomycin A1处理细胞,使得SPiDER-βGal可以与SA-β-gal反应,并对衰老细胞进行荧光染色。 下图显示了添加和不添加Bafilomycin A1时检测SA-β-gal的差异。 由于Bafilomycin A1也被用作自噬的抑制剂。使用时,请考虑是否会对实验体系有影响,如果有影响,建议固定细胞。细胞固定时,缓冲液会控制细胞内的pH,所以不需要使用Bafilomycin A1。可以参照操作说明书中的步骤进行染色。
|
| Q3: DMSO stock solution 可以稳定保存多久? |
| A3: SPiDER-βGal DMSO stock solution和Bafilomycin A1 DMSO stock solution配制后,-20℃可以稳定保存1个月。 |
| Q4: Working solution可以稳定保存多久? |
| A4: SPiDER-βGal working solution和Bafilomycin A1 working solution无法长期保存,请现配现用。 |
| Q5: 做细胞衰老的荧光观察时有哪些注意事项? |
| A5: 随着细胞的衰老,被称为脂褐素(Lipofuscin)的不溶性物质会在细胞中积聚。 脂褐素自身会产生荧光,进而增加荧光背景。 在这种情况下,我们建议您准备不含SPiDER-βGal的样品,以准确评估衰老细胞中的SA-β-gal活性。 流式细胞仪检测 ・测定“衰老细胞”和“正常细胞”的平均荧光强度(MFI) ①添加了SPiDER-βGal的细胞 ②未添加SPiDER-βGal的细胞 (背景) ・“①的平均荧光强度”减去“②的平均荧光强度” 用扣除背景后的SA-β-gal的荧光来表征SA-β-gal的活性。 a:SA-β-gal活性(衰老细胞):=①的平均荧光强度 - ②的平均荧光强度 b:SA-β-gal活性(正常细胞):=①的平均荧光强度 - ②的平均荧光强度 ・通过比较上述a和b的值来评价SA-β-gal的活性。 另外,通过a减去b的差值可以确定细胞衰老所引起的SA-β-gal活性的变化。 荧光显微镜检测 ・首先,使用未添加SPiDER-βGal的衰老细胞进行荧光观察。 ・调整灵敏度(Gain等),直至来生自脂褐素的荧光(背景)不影响荧光图像为止。 ・在相同的成像条件下,再对添加了SPiDER-βGal的细胞或正常细胞进行荧光观察。 |
| Q6: 细胞固定后还可以对SA-β-gal进行染色吗? |
| A6: 可以。如果固定细胞,则不需要用Bafilomycin A1预处理细胞,但是需要制备pH调节至6的Mcllvain Buffer。详细的操作请参考操作说明书。 |
| Q7: 请问是否有细胞固定后进行流式细胞仪操作的具体步骤? |
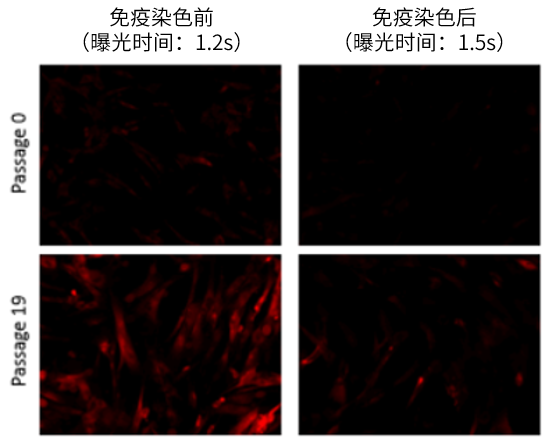
| A7: 可以。但是请注意细胞固定可能会影响SA-β-gal(请参考下面的*2) 以下的实验例供作参考。 WI-38细胞固定后,进行SA-β-gal检测和γ-H2AX (DNA损伤标志物)的免疫染色。 <实验操作> (1) 将WI-38细胞播种至35 mm dish,37℃,5% CO2培养箱中过夜培养。 (2) 去除上清,加入2 ml 4% Pa raformaldehyde/PBS溶液,室温培养3 min*1。 (3) 用2 ml PBS清洗细胞3次。 (4) 添加2 ml SPiDER-βGal working solution *2, 37℃培养30 min*3。 (5) 用2 ml PBS清洗细胞2次。 (6) 加入2 ml 0.1% Tritox X-100/PBS, 室温培养30 min。 (7) 用2 ml PBS清洗细胞2次。 (8) 加入 2ml 1% BSA/PBS溶液,室温培养1 h。 (9) 用1% BSA/PBS溶液稀释过的抗γ-H2AX IgG(小鼠来源),加入至细胞后室温培养1 h (10) 用2 ml PBS清洗细胞3次。 (11) 用1% BSA/PBS溶液稀释过的抗小鼠IgG(Cy5标记),加入至细胞后室温培养1 h。 (12)去除上清,用2 ml PBS清洗细胞2次后进行荧光显微镜观察。 *1 细胞固定时间越长,对SA-β-gal活性的影响越高。*2 细胞固定操作有可能会降低SA-β-gal的活性。如果检测SA-β-gal时,荧光强度较弱,请尝试将SPiDER-βGal DMSO stock solution 稀释500-1000倍使用。通常SPiDER-βGal DMSO stock solution 建议用Mcllvaine buffer (pH 6.0)稀释2,000倍使用。 *3 培养时不使用5% CO2培养箱。细胞固定后使用5% CO2培养箱的话,缓冲液会变为酸性,从而使得内在性β-galactosidase的活性上升,导致背景升高,无法辨别衰老细胞和年轻细胞的内的SA-β-gal活性的差值。 <实验数据> 通过比较免疫染色前后的SPiDER-βGal的荧光强度,可以发现固定后的免疫染色过程中SPiDER-βGal的荧光强度降低了。 图2. 不同稀释倍率的SPiDER-βGal染色结果 (免疫染色后) 红色:SPiDER-βGal 蓝色:γ-H2AX <曝光时间: 1.5 s>通过将SPiDER-βGal工作溶液的稀释比从2000倍更改为666倍,可以确认通过免疫染色(固定化)降低的SPiDER-βGal荧光强度与免疫染色前的强度相当。 |
| Q8: 染色操作后发现荧光很弱,无法观察,请问是否有改善的方法? |
| A8: 请确认如下三个注意事项。 ①使用的滤光片是否与染色试剂匹配。 <推荐的滤光片> · 荧光显微镜:激发(500-540 nm),荧光(530-570 nm) · 流式细胞仪:激发(488 nm), 荧光(500-540 nm) ②各working solution是否为现配现用。 ③延长染色时间 添加SPiDER-βGal working solution后,培养30 min后无法观察到荧光的话,考虑延长至45-60 min再进行荧光观察。 |
| Q9: 确认含有SA-β-Gal的细胞染色后,是否可以进行细胞固定? |
| A9: 可以。建议使用4%的多聚进行细胞固定。 |
| Q10: 培养基中的血清和酚红是否会影响检测? |
| A10: 培养基中的血清和酚红对SA-β-gal的检测没有影响。 |
| Q11:衰老细胞和正常细胞没有差异时,应该怎么确认? |
|
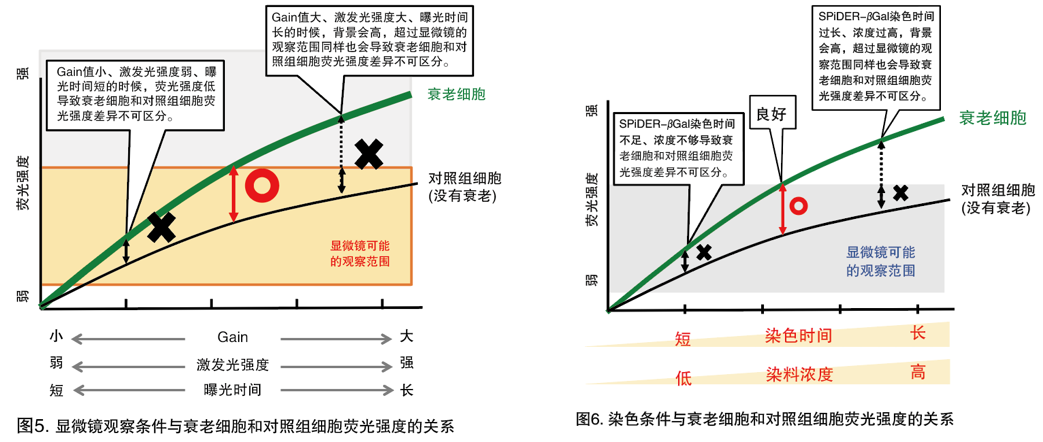
A11: STEP1:优化显微镜的观察条件。 STEP2:如果优化观察条件仍无法解决,请对染色条件进行优化。STEP1<优化显微镜的观察条件> 如果衰老细胞和对照组细胞之间的荧光强度没有差异,请按照以下步骤进行调整。 1. 观察对照组细胞,通过降低激发光强度,Gain值或缩短曝光时间等条件将仪器调节至可以观察到微弱荧光的状态。 (共聚焦显微镜:调整Gain值、激发光强度 落射型显微镜:调整曝光时间) 2. 慢慢增强激发光强度,延长曝光时间,观察衰老细胞的荧光变化,寻找到衰老细胞和对照组细胞之间的最大荧光差异的条件。 ·如果两者荧光没有差异,请参考STEP2。 ※请使用玻璃底的培养皿容器观察。 STEP2<染色条件的优化> 根据不同的细胞种类,可能需要调整SPiDER-βGal的染色时间和工作液浓度。 以下为最佳条件的参考数据。 染色时间:10-60 min 染色浓度:说明书中1/2-2倍的浓度 分别加入不同浓度的工作液,并调整不同的染色时间,寻找到衰老细胞和对照组细胞之间的最大荧光差异的条件。 *如果观察的细胞数少的话,有可能灵敏度不够。必要时,需要调整细胞数量
|
| Q12.如何准备药物阳性对照组 |
|
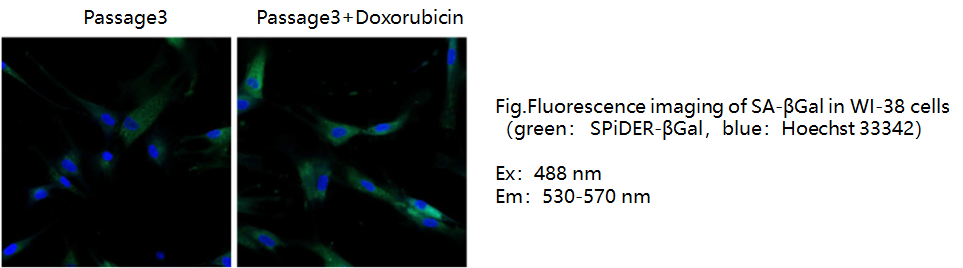
A12:参考如下案例 衰老诱导(阿霉素处理的WI-38细胞) 1.将第3代的WI-38细胞(1×10^6细胞/皿,MEM,10%胎牛血清,1%青霉素-链霉素)接种在10 cm培养皿中,并在5%CO2中于37℃培养箱中培养过夜。2.除去培养基,并用10 ml PBS洗涤细胞一次。 3.用无血清MEM制备0.2μmol/ L的阿霉素。 如果没有无血清的培养基,可以使用含血清的培养基。 4.向培养皿中加入阿霉素(10 mL),并在5%CO2培养箱中于37℃培养3天。 5.除去上清液,并用10 ml PBS洗涤细胞一次。 6.向培养皿中加入MEM(10%胎牛血清,1%青霉素-链霉素),并在5%CO2恒温箱中于37℃培养3天。 7.除去培养基,并用10 ml PBS洗涤细胞一次。 8.胰酶消化细胞,分别用阿霉素和不用阿霉素处理。 |
| 固定细胞成像 1.在8孔ibidi中准备细胞进行测定,并在5%CO2恒温箱中于37℃过夜培养细胞。 2.除去培养基。 用PBS洗涤细胞一次。 向细胞中加入4%多聚 (PFA)/ PBS溶液,并在室温下孵育3分钟。 3.除去上清液。 用PBS洗涤细胞两次。 4.混合SPiDER-βGal工作溶液(2 mL)和1mg / mL Hoehst 33342(2μl)。 将混合溶液(200μl)加入孔中,并在37℃孵育30分钟。 *我们建议不要在固定细胞实验中使用5%CO2培养箱。如果在5%CO2培养箱中进行培养,则缓冲液的pH值可能会呈酸性。 酸性pH导致内源性β-半乳糖苷酶活性的背景升高,因此很难区分正常细胞和衰老细胞。 5.除去上清液。 用PBS洗涤细胞两次。 6.在荧光显微镜下观察细胞。
|
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验Colorimetric Detection of Senescence-Associated Galactosidase
, we described the “senescence-associated β galactosidase” (SA-βgal) biomarker, which conveniently identifies individual senescent cells in vitro and in vivo. Here, we describe an updated protocol for the detection of cell senescence based on this widely used
三句话读懂一篇 CNS:线粒体突变降低癌症死亡风险 57% 以上;解密大猩猩捶胸口之谜...
. Wiley 研究组在 Cell Metabolism 杂志上发表论文 Oxylipin biosynthesis reinforces cellular senescence and allows detection of senolysis,研究发现衰老细胞能够合成并积累细胞内前列腺素 1a, 1b - 二同型 - 15 - 脱氧 -δ-12,14 - 前列腺素 J2(Dihomo-15d-PGJ2),释放的 15 - 脱氧 -δ-12,14 - 前列腺素 J2 是体内和体外衰老的生物标志物。衰老
-Jones) In situ hybridization (ISH) is the detection of a target DNA or RNA sequence in a tissue section using a labeled nucleic acid probe. It is still the only hybridization technique which allows cellular and subcellular localization of the target
 技术资料
技术资料需要更多技术资料 索取更多技术资料
资料下载:
SG03宣传资料(CN)第1版_针对用X-Gal做细胞衰老实验客户(1).pdf 附 (下载 10 次)
SG03宣传资料(CN)第1版_针对初次做细胞衰老实验客户.pdf 附 (下载 18 次)
SG03宣传.pdf 附 (下载 7 次)
请 [登录] 后再下载!