相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 提供商:
表观生物
- 服务名称:
TurboID相分离蛋白互作研究利器
- 规格:
10G*2(IP+input)
(图来自Creative Proteomics)
在生命科学领域,深入理解细胞内蛋白质的相互作用网络及其动态变化,是揭示生命活动本质的关键。蛋白质并非孤立发挥功能,而是通过相互协作形成复杂的分子复合体,执行特定的生物学功能。为解析这些复杂的相互作用,研究人员不断开发新的技术和方法。近年来,邻近标记技术(Proximity Labeling)已成为研究蛋白质相互作用和细胞微环境的有力工具。其中,TurboID技术凭借其卓越的性能,在众多邻近标记技术中脱颖而出。
早期的邻近标记技术,如BioID,虽然能够鉴定蛋白质的邻近互作蛋白,但存在标记效率较低、所需标记时间较长等局限,限制了其在动态生物过程研究中的应用。为了突破这些瓶颈,华人科学家Alice Ting(邓红文教授)团队以前瞻性的眼光,创新性地对BioID酶进行了定向进化改造[1]。
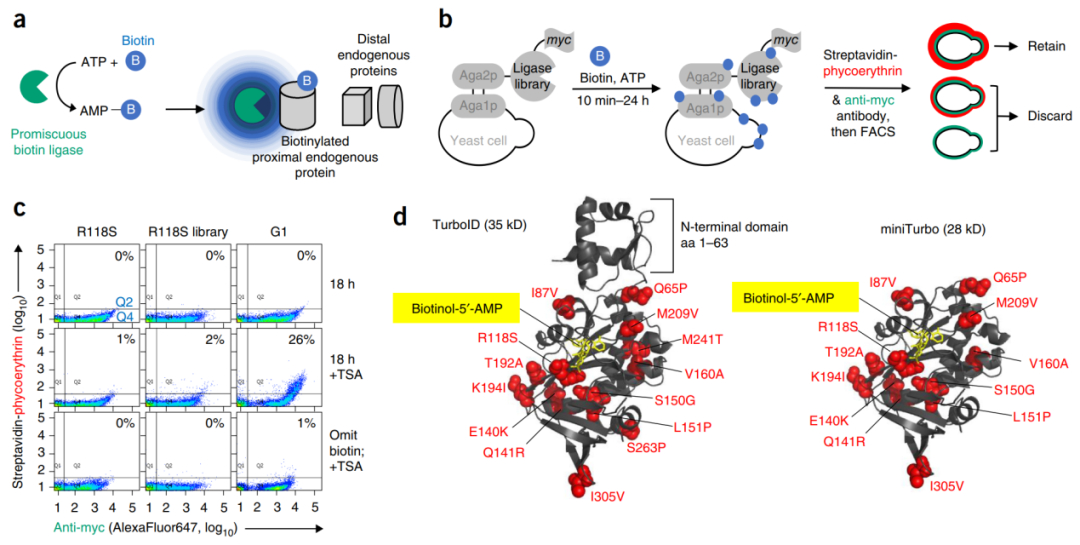
图1. TurboID 的定向进化
●显著提升的生物素化活性:TurboID和miniTurbo均表现出远高于BioID的生物素化效率,标记速度更快,能够在更短的时间内完成邻近蛋白质的标记。
●更短的标记时间窗口:TurboID和miniTurbo的高效性使其能够更精准地捕捉瞬时和动态的蛋白质相互作用,这对于研究快速变化的细胞过程至关重要。
●miniTurbo的小尺寸优势:miniTurbo的分子量约为TurboID的一半,这一特性使其具有更易于基因编辑递送、更低的空间位阻效应以及潜在的更优细胞穿透性等优势,在特定应用中展现出更大的潜力。
表1. 用于鉴定蛋白质相互作用的邻近标记酶的对比
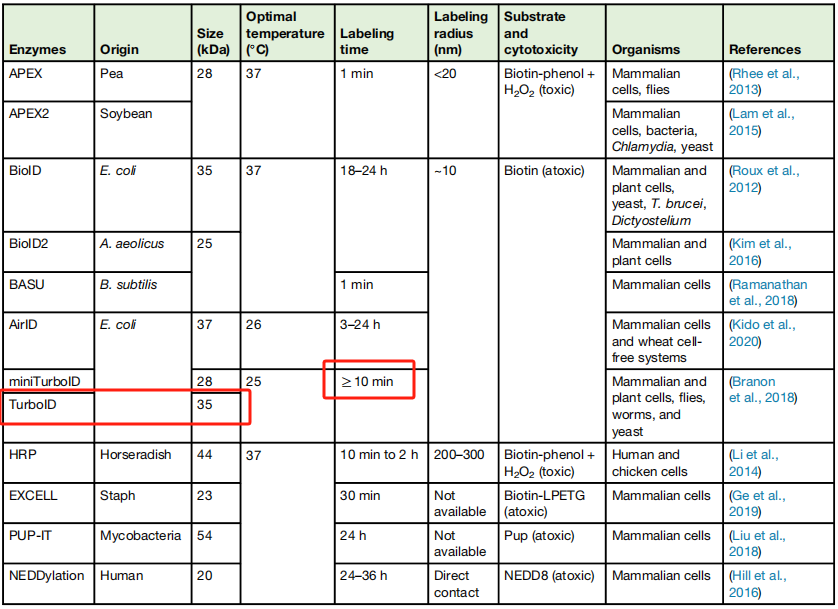
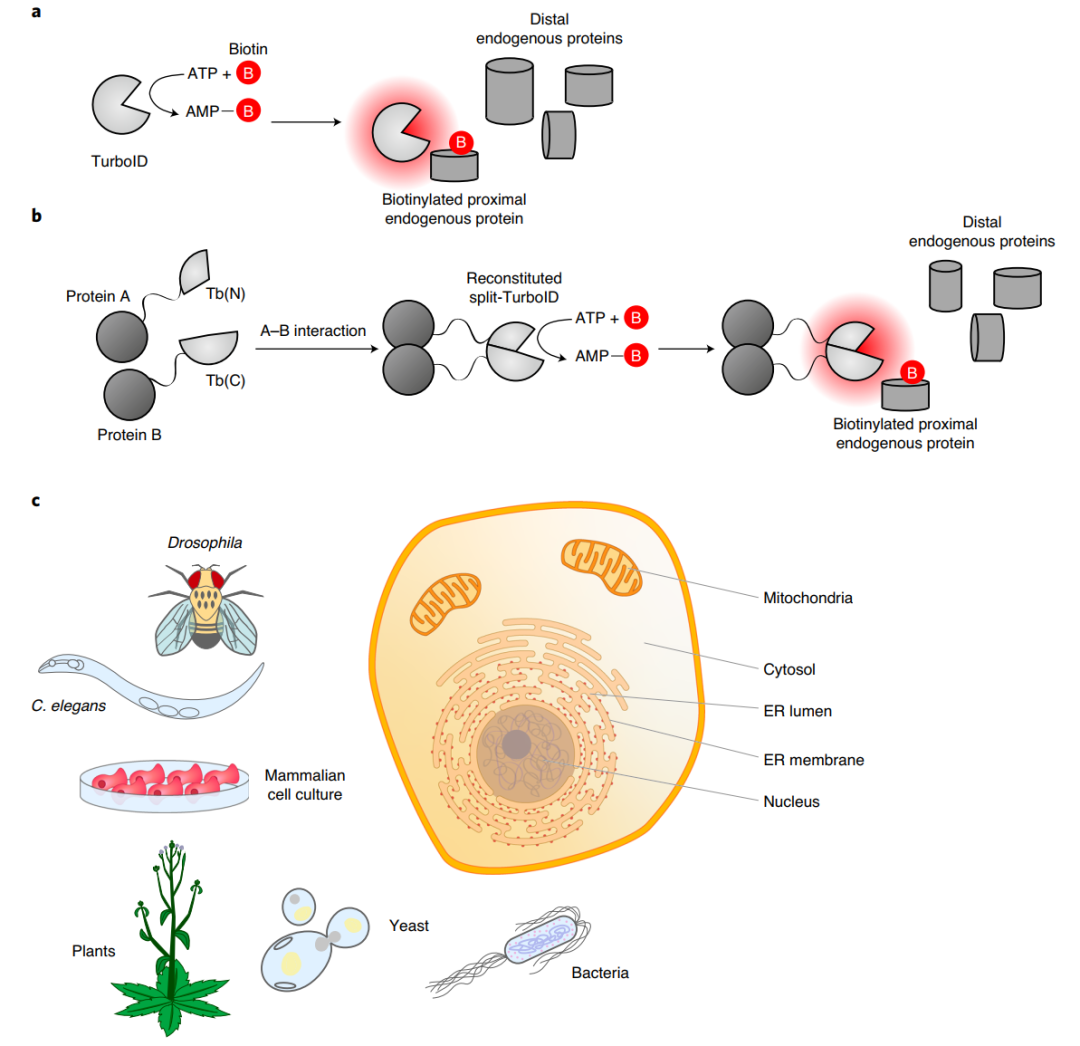
图2. TurboID和split-TurboID催化的邻近依赖性生物素化
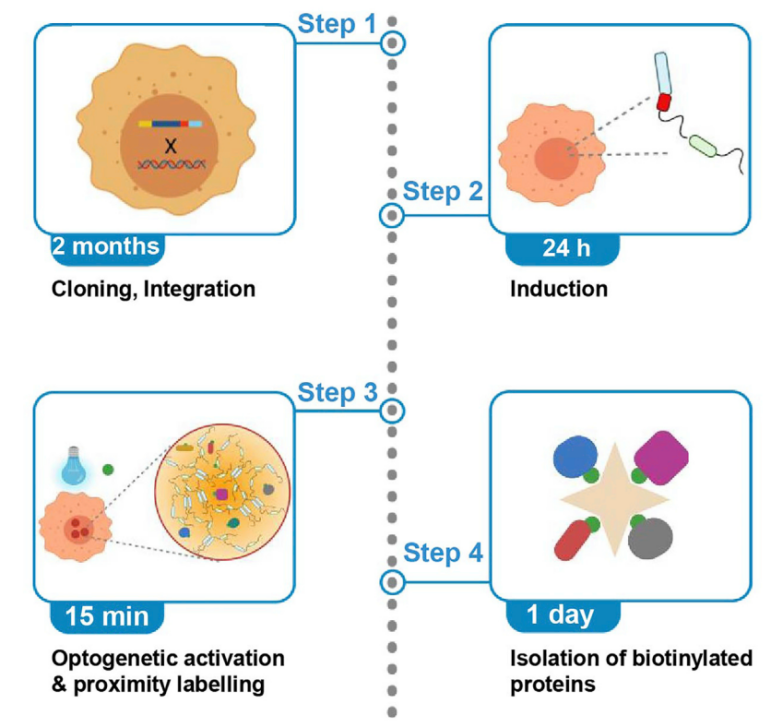
图3. Alghoul E et al., STAR Protoc 2021
另外,Ting团队在TurboID技术的基础上,创新性地开发了TransitID(蛋白运输TurboID)技术[4]。TransitID技术的核心创新在于设计了两种特殊类型的TurboID酶,即分泌型TransitID(Sec-TransitID)和膜锚定型TransitID(TM-TransitID),分别用于捕捉不同类型的蛋白质运输事件。
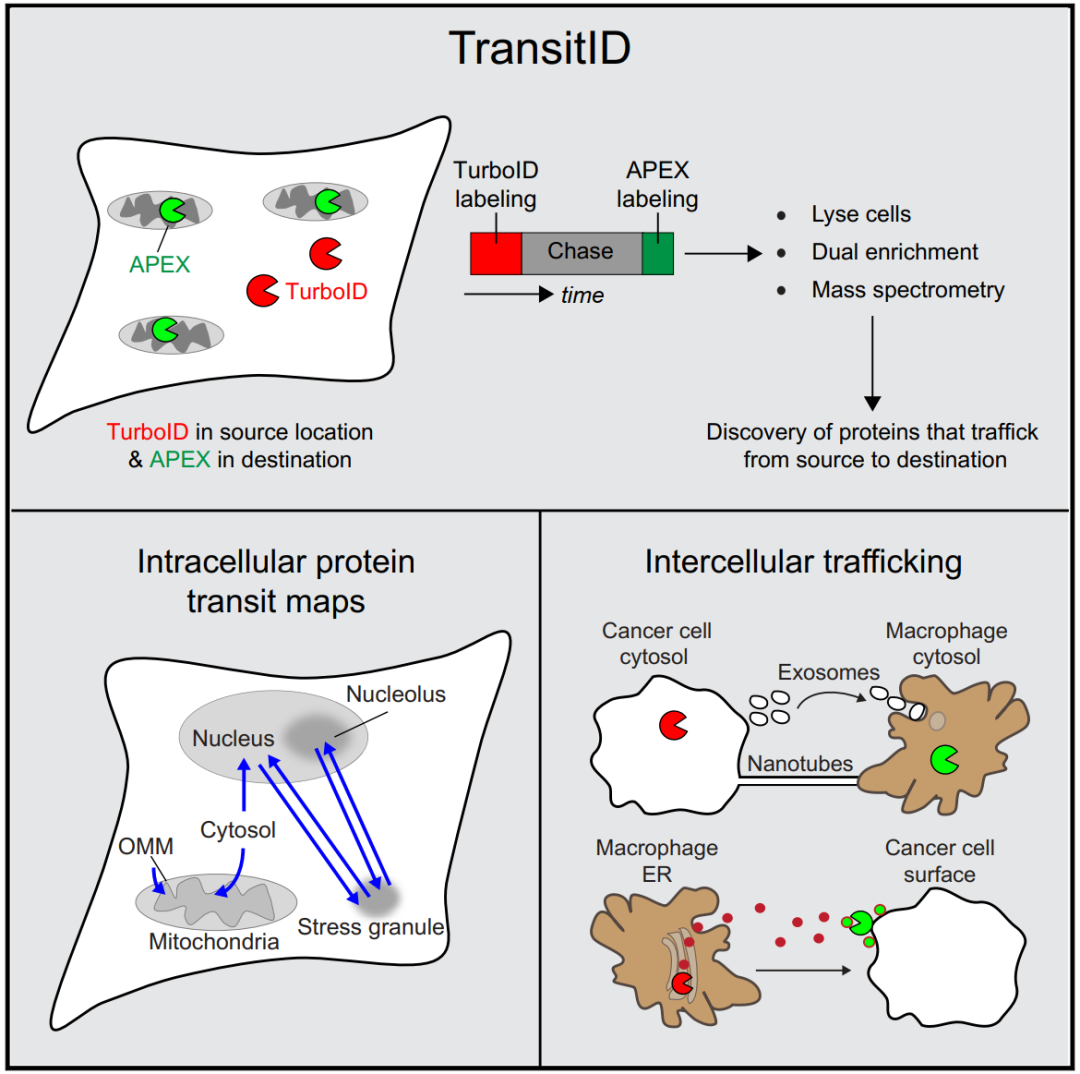
图4. Qin W et al., Cell 2023[4]
近年来,生物大分子相分离成为生物学领域最前沿、最热门的研究方向之一。相分离是指细胞内的蛋白质和核酸等生物大分子,通过液-液相分离自组装形成具有特定功能和结构的凝聚体(Condensates)的现象。这些凝聚体在细胞的各种生命活动中发挥着至关重要的作用,异常的相分离则与多种疾病的发生密切相关。TurboID在相分离研究中的应用逐渐增多,尤其在揭示无膜细胞器的动态组成和蛋白质互作网络方面展现出独特优势。
●靶点筛选:高效鉴定疾病相关凝聚体的关键组分
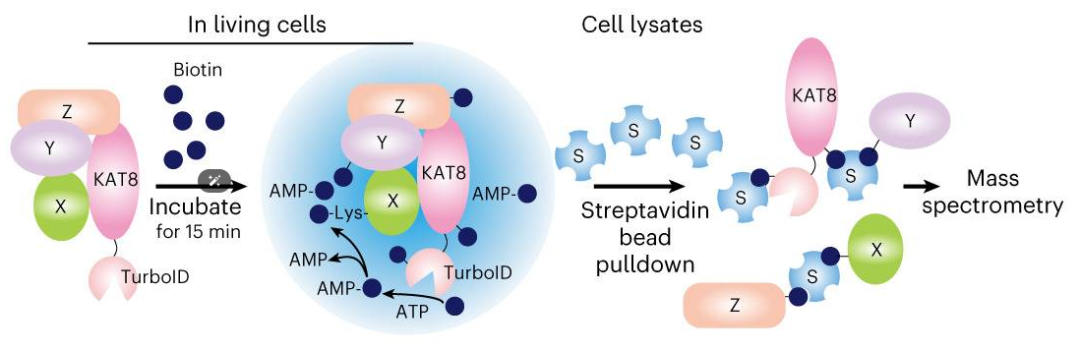
图5. V5-TurboID标签的KAT8的邻近标记系统的示意图
●HERD-1凝聚体:TurboID技术在线虫研究中发现,HERD-1蛋白形成的凝聚体,参与调控小RNA介导的跨代遗传,这意味着上一代的某些生活经历,可以通过相分离调控的表观遗传机制,影响到后代[6]。
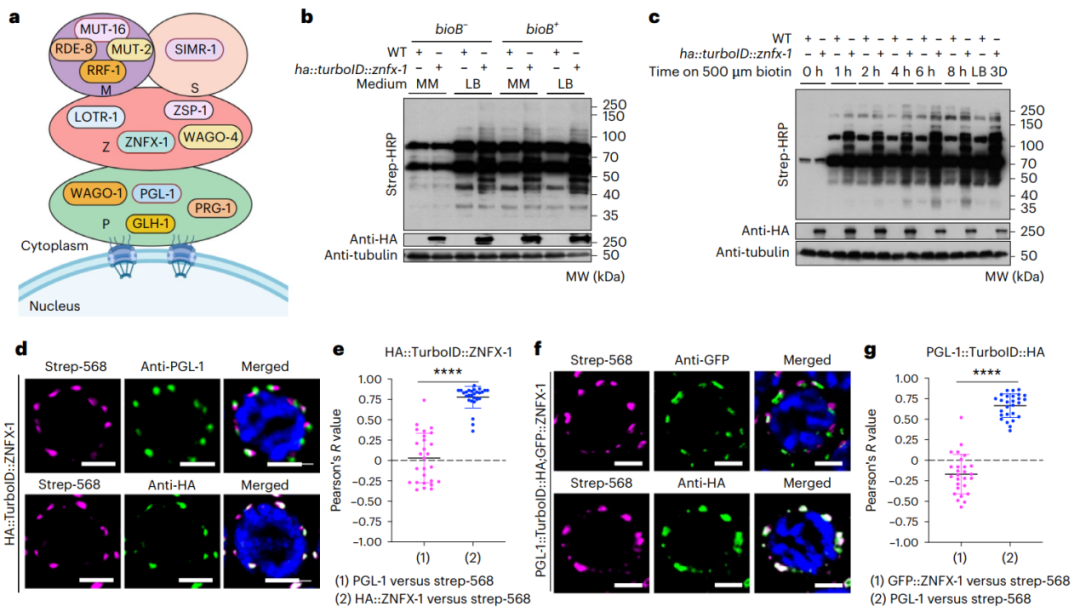
图6. PZMS区室的建立和TurboID标记的优化
●TRIAD3A与tau蛋白纤维化:研究人员发现TRIAD3A(一种E3泛素连接酶)通过嵌套相分离(nested phase separation)促进tau蛋白的淀粉样纤维化。TurboID被用于筛选TRIAD3A的邻近底物,鉴定出包括tau在内的多种与神经退行性疾病相关的蛋白。该研究揭示了相分离在tau病理聚集中的关键作用,并发现溶酶体抑制会加剧tau淀粉样蛋白积累,为阿尔茨海默病等疾病的机制提供了新视角[7]。
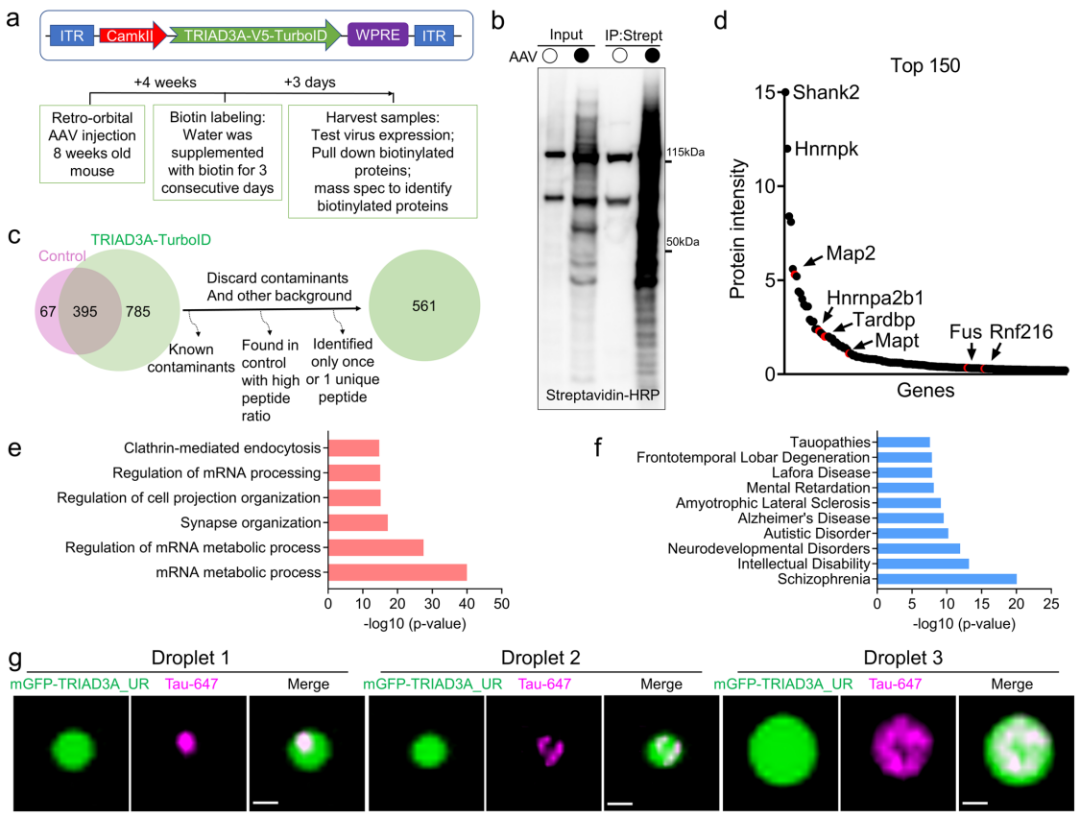
图7. TRIAD3A介导的自噬货物候选物的鉴定
●TPM4相分离调控糖酵解与微丝动态:文章利用TurboID-MS技术发现,微丝结合蛋白TPM4在高渗应激下通过相分离形成凝聚体,招募糖酵解酶(如HK1、PGK1等),促进局部ATP生成,从而反馈调控微丝骨架重排。该研究首次揭示了相分离在细胞骨架与能量代谢偶联中的枢纽作用,并通过小鼠肾脏切片验证了病理状态下的TPM4凝聚体与糖酵解酶共定位[8]。
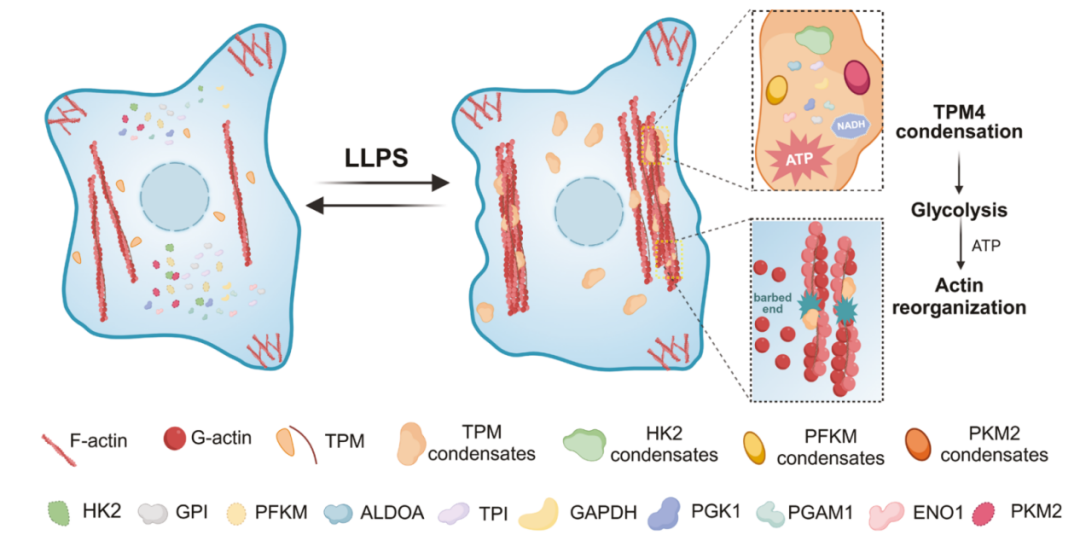
图8. 用于TPM4相分离介导的多种糖酵解酶的重组的模型示意图
TurboID技术作为一项先进的邻近标记技术,极大地推动了蛋白质互作和细胞微观世界的研究。尤其在快速发展的相分离领域,TurboID技术已经并将继续发挥关键作用,随着技术的不断发展和完善,TurboID有望在揭示生命活动基本规律、阐明疾病发病机制以及指导新药研发等方面发挥更重要的作用。
TurboID邻近标记技术相分离凝聚物是细胞内动态的无膜细胞器,其成分分析对于深入理解其形成机制和功能至关重要。传统的分离方法在处理这些动态结构时往往力不从心。近年来,TurboID等邻近标记技术为相分离研究带来了革命性突破。
为助力更多科研工作者快速高效地开展相分离相关研究,表观生物推出TurboID邻近标记技术,该技术利用经工程化改造的生物素连接酶,在活细胞内以高时空分辨率标记目标蛋白的邻近蛋白,无需抗体,即可高效捕获稳定、瞬时或弱相互作用。尤其在低丰度蛋白、膜蛋白互作以及新兴的生物大分子相分离研究中,TurboID展现出卓越的性能。
技术原理
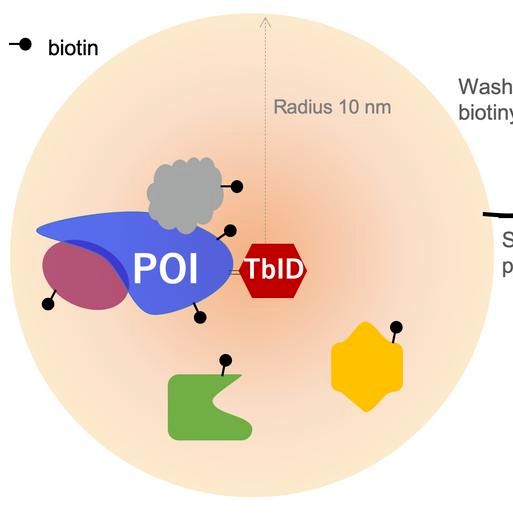
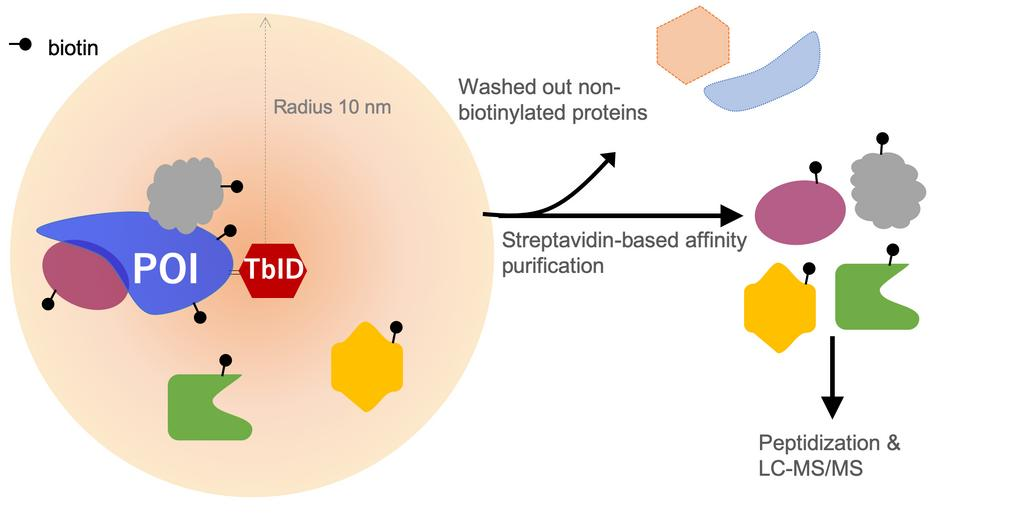
TurboID邻近标记技术是通过将TurboID生物素连接酶与目标蛋白融合表达后,可在活细胞内催化生物素与ATP反应,生成具有高反应活性的生物素-5'-AMP中间体。该中间体能够与目标蛋白邻近蛋白(包括相互作用蛋白和空间位置接近的蛋白)上的赖氨酸残基发生共价结合,从而实现对邻近蛋白的生物素化标记。随后,利用链霉亲和素磁珠高效富集这些被生物素标记的蛋白,这些蛋白可以分解肽段后进行质谱(MS)鉴定,也可以提取RNA后进行高通量转录组测序。从而获取目标蛋白的相互作用网络和邻近蛋白信息[9]。
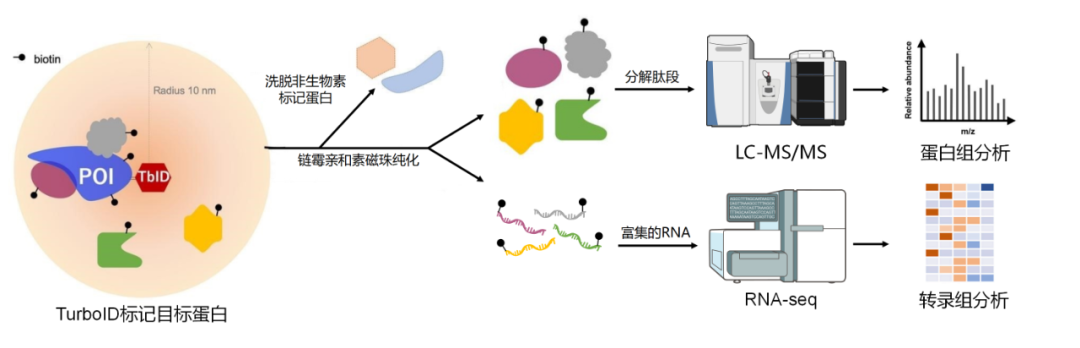
图9. TurboID技术服务流程示意图[9]
技术优势
-
在最佳生理条件的活细胞内进行标记,更真实地反映体内蛋白质相互作用;
-
标记时间短,能够高效捕获瞬时或弱相互作用;
-
利用生物素-链霉亲和素的强非共价结合,允许使用强变性条件洗涤,有效降低非特异性结合,提高信噪比;
-
适用低丰度/膜蛋白;
-
不受细胞区室化影响;
-
无需高质量抗体和高纯度蛋白;
-
可广泛应用于蛋白互作、激酶底物筛选、亚细胞定位、生物大分子相分离等多种研究领域。
应用方向
-
鉴定新型互作蛋白,构建动态蛋白互作图谱;
-
生物大分子相分离研究,如凝聚体蛋白质组、相分离调控机制、疾病相关相分离;
-
酶底物筛选,鉴定难以找到底物的酶,研究酶-底物相互作用的动态性;
-
亚细胞蛋白质组学研究,如特定细胞器蛋白质组、细胞膜蛋白质组、细胞核亚结构;
-
蛋白质翻译后修饰研究,鉴定修饰位点附近的蛋白,研究翻译后修饰对蛋白互作的影响;
-
将TurboID融合到与特定RNA结合的蛋白上,也可用于研究RBP。
基于TurboID技术的相分离服务
1. 生物素标记效率验证(Western Blot)
(1)实验目的:验证TurboID系统在加入生物素后,是否成功实现了对目标蛋白及其邻近蛋白的生物素化标记。这是确保后续实验数据可靠性的首要质控步骤。
(2)数据呈现:高质量WB图像
●泳道设置:WB图像通常包含以下泳道:
(3)抗体检测:WB膜将使用以下抗体进行检测:
●生物素抗体(Anti-Biotin):检测总蛋白生物素化水平。如果TurboID标记成功,实验组(+Biotin)的总蛋白生物素化水平应显著高于Control组,并在目标蛋白分子量附近出现明显的生物素化条带
●目标蛋白抗体(Anti-Target Protein):检测目标蛋白的表达水平。确保各组目标蛋白表达水平基本一致,排除蛋白表达量差异对实验结果的影响
(4)目标蛋白标记特异性(间接验证):虽然WB检测的是总蛋白生物素化水平,但结合后续的免疫荧光成像和质谱分析,可以间接推断目标蛋白及其邻近蛋白被有效标记
(5)数据解读:通过WB结果,可以判断生物素标记效率:生物素抗体检测结果是否证实TurboID系统在加入生物素后成功实现了蛋白的生物素化标记
2. 液滴共定位验证(免疫荧光成像)
(1)实验目的:通过高分辨率免疫荧光成像,直观展示生物素标记信号与目标蛋白在细胞内相分离液滴中的共定位情况,确认标记的特异性
(2)数据呈现:高质量的多通道免疫荧光共聚焦显微镜图像
●荧光通道设置:图像通常包含多个荧光通道,叠加展示:
(3)图像分析:我们将提供代表性的细胞图像,并进行图像共定位分析(例如,皮尔逊相关系数分析),定量评估生物素标记信号与目标蛋白液滴的共定位程度
(4)液滴形态与生物素标记分布:观察生物素标记信号在液滴内部、液滴边缘或液滴周围的分布模式,初步了解液滴内部和周围蛋白的生物素化情况
(5)数据解读:通过免疫荧光成像结果,可以看到生物素标记信号与目标蛋白液滴共定位:在Merge通道中,绿色生物素标记信号应与目标蛋白液滴(根据目标蛋白抗体染色结果判断)是否在空间上高度重合,从而证实TurboID标记是否发生在目标蛋白相分离液滴的微环境中
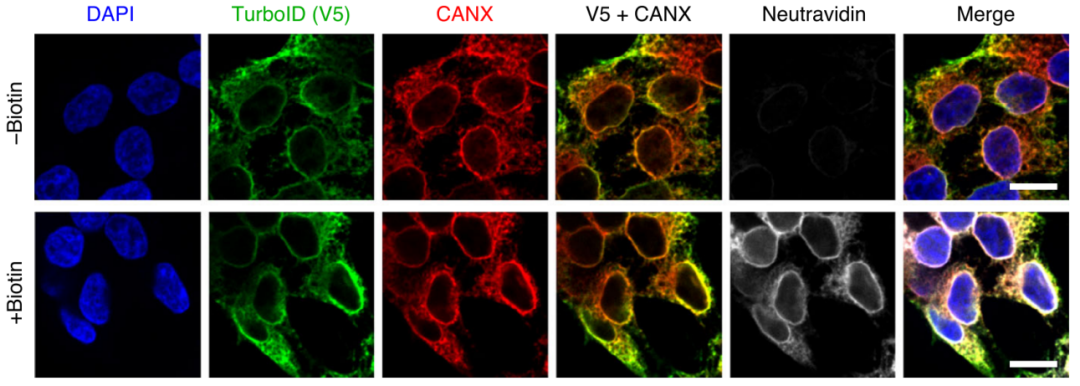
图10. HEK293T细胞稳定表达ERM靶向TurboID的共聚焦荧光成像[2]
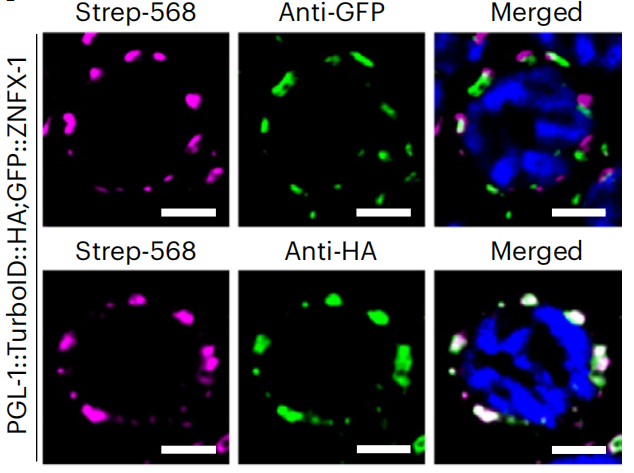
图11. 共聚焦荧光成像示意图[6]
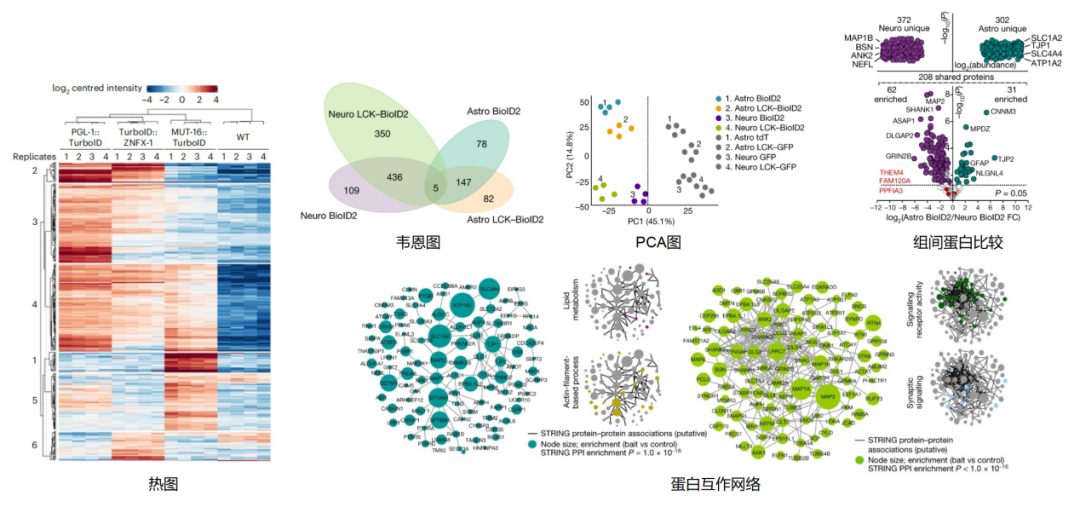
图12. TurboID蛋白组学分析结果示例[6,10]
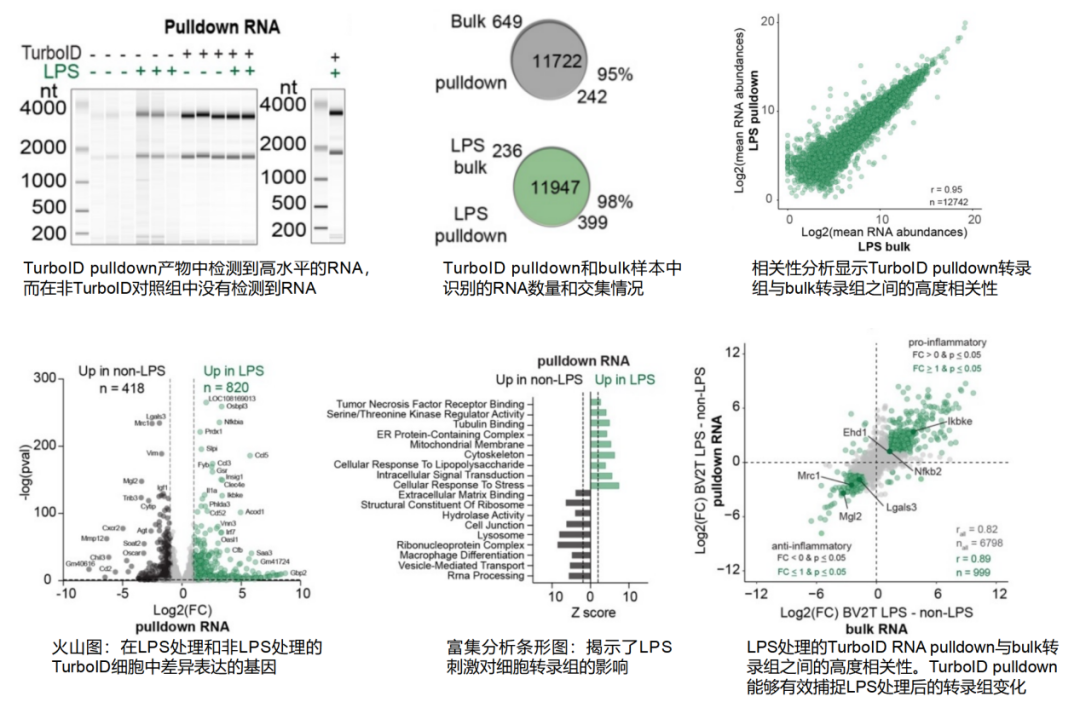
图13. TurboID转录组分析结果示例[11]
送样要求
活细胞或冻存细胞,具体样本类型和样本要求请咨询科研顾问。
研究案例
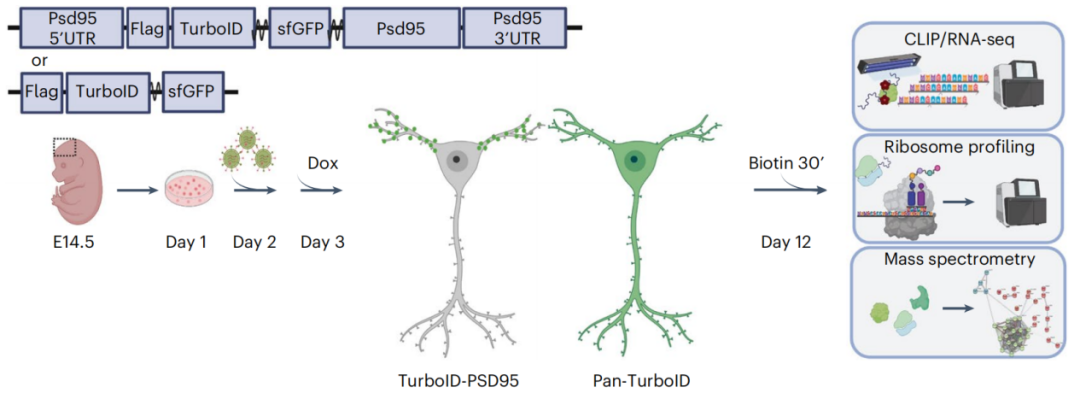
图14. 实验设计示意图
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验[1] Branon TC, Bosch JA, Sanchez AD, et al. Efficient proximity labeling in living cells and organisms with TurboID. Nat Biotechnol. 2018;36(9):880-887. doi:10.1038/nbt.4201
[2] Cho KF, Branon TC, Udeshi ND, Myers SA, Carr SA, Ting AY. Proximity labeling in mammalian cells with TurboID and split-TurboID. Nat Protoc. 2020;15(12):3971-3999. doi:10.1038/s41596-020-0399-0
[3] Alghoul E, Basbous J, Constantinou A. An optogenetic proximity labeling approach to probe the composition of inducible biomolecular condensates in cultured cells. STAR Protoc. 2021;2(3):100677. Published 2021 Jul 22. doi:10.1016/j.xpro.2021.100677
[4] Qin W, Cheah JS, Xu C, et al. Dynamic mapping of proteome trafficking within and between living cells by TransitID. Cell. 2023;186(15):3307-3324.e30. doi:10.1016/j.cell.2023.05.044
[5] Wu Y, Zhou L, Zou Y, et al. Disrupting the phase separation of KAT8-IRF1 diminishes PD-L1 expression and promotes antitumor immunity. Nat Cancer. 2023;4(3):382-400. doi:10.1038/s43018-023-00522-1
[6] Zhao C, Cai S, Shi R, et al. HERD-1 mediates multiphase condensate immiscibility to regulate small RNA-driven transgenerational epigenetic inheritance. Nat Cell Biol. 2024;26(11):1958-1970. doi:10.1038/s41556-024-01514-8
[7] Zhou J, Chuang Y', Redding-Ochoa J, et al. The autophagy adaptor TRIAD3A promotes tau fibrillation by nested phase separation. Nat Cell Biol. 2024;26(8):1274-1286. doi:10.1038/s41556-024-01461-4
[8] Yang W, Wang Y, Liu G, Wang Y, Wu C. TPM4 condensates glycolytic enzymes and facilitates actin reorganization under hyperosmotic stress. Cell Discov. 2024;10(1):120. Published 2024 Dec 3. doi:10.1038/s41421-024-00744-2
[9] Garloff V, Krüger T, Brakhage A, Rubio I. Control of TurboID-dependent biotinylation intensity in proximity ligation screens. J Proteomics. 2023;279:104886. doi:10.1016/j.jprot.2023.104886
[10] Soto JS, Jami-Alahmadi Y, Chacon J, et al. Astrocyte-neuron subproteomes and obsessive-compulsive disorder mechanisms. Nature. 2023;616(7958):764-773. doi:10.1038/s41586-023-05927-7
[11] Ramelow CC, Dammer EB, Xiao H, et al. Simultaneous profiling of native-state proteomes and transcriptomes of neural cell types using proximity labeling. Preprint. bioRxiv. 2025;2025.01.29.635500. Published 2025 Feb 1. doi:10.1101/2025.01.29.635500
[12] Hacisuleyman E, Hale CR, Noble N, et al. Neuronal activity rapidly reprograms dendritic translation via eIF4G2:uORF binding. Nat Neurosci. 2024;27(5):822-835. doi:10.1038/s41593-024-01615-5
 技术资料
技术资料暂无技术资料 索取技术资料