相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 库存:
100个
- 英文名:
StarLighter Library Quantification Kit(Ion Torrent)
- 保质期:
18个月
- 供应商:
北京启衡星生物科技有限公司
- 规格:
500rxns
StarLighter Library Quantification Kit(Ion Torrent)
StarLighter 文库定量试剂盒(Ion Torrent)
产品描述:
本说明书提供了适用于Ion Torrent平台的StarLighter Library Quantification Kit(ROX)的产品信息和详细方案。
本文件适用于Ion Torrent平台的StarLighter Library Quantification Kit(ROX),适用于lon Torrent平台标准品和引物试剂盒;适用于Ion Torrent平台的文库定量标准品试剂盒。扩增文库分子的准确定量对于有效使用Ion Torrent 二代测序(NGS)平台的至关重要——高估文库会导致emPCR期间含DNA的微粒太少,而低估文库会导致每个微拉结合多个模板分子。当不同index标记的文库同时测序时,准确的文库定量结果对于每个文库拥有相同量的有效测序数据也是同样重要的。
qPCR本质上非常适合NGS文库定量,因为它克服了其他方法带来的许多问题,例如:
1、它只对和emPCR优化相关的PCR扩增的文库分子进行定量:。
2、在极宽的动态范国内具有很高的灵敏度和准确性。
3、适用于高通量样品和自动化液体处理。qPCR的高灵敏性可以保证对非常低浓度文库的精确定量,这最大限度地减少了文库的PCR扩增需求和由此引起的偏差。
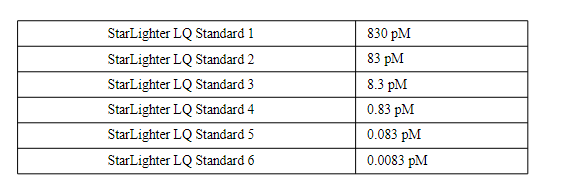
StarLighter Library Quantification Kit(ROX)由DNA标准品(6个10倍稀释梯度标准品),定量引物Primer Premix(10X)和StarLighter SYBR Green qPCRmix组成,可以精确定量NGS文库中可扩增分子的数量。153 bp的lon TorrentDNA标准品由一个线性DNA片段组成,该DNA片段两侧有qPCR引物结合位点。通过使用6个DNA标准品生成的标准曲线来实现文库定量。
StarLighter Library Quantification Kit(ROX)经过严格测试以确保最小的批间差。该试剂盒包含新型DNA聚合酶,专为高效的SYBR Green I为基础的qPCR设计。此聚合酶具有以相似的效率来扩增不同DNA片段的能力,所以可以作为通用的标准去对平均片段长度高达1kb的文库进行定量,文库类型或GC含量对此没有影响。StarLighterLibraryOuantification Kit(ROX)适用于对含有以下qPCR引物序列的Ion Torrent接头构建的文库进行定量。Primer IT A: 5'-CCA TCT CAT COC TGC GTG TC - 3'Primer IT trP1: 5'-CCT CTC TAT GGG CAG TCG GTG AT-3
运输和存储:
根据目的地不同,StarLighter Library Quantification Kit(ROX)以干冰或冰块运输。收到后,将整个试剂盒储存在-159C至-25℃℃恒温冰箱中。在保质期内,在这些条件下储存并正确操作的情况下,所有试剂盒的组分都将保留完整活性。
注意事项:
在使用前务必须确保各成分完全溶解并充分混合。即使在-15°C至-25°C的温度下储存,StarLighter SYBR Green gPCR mix Mix(ROX)也可能不完全冻结成固体。SYBR Green I染料和ROX染料(包含在StarLighter SYBR Green qPCR mix Mix(ROX)中)对光敏感,长时间暴落于光下会导致荧光信号强度的损失。
StarLighter Library Quantification kit(ROX)-lon Torrent的所有组分均可经过30次反复冻融后保持稳定。不使用时,确保所有试剂避光储存在-15C至-25℃C条件下。StarLighterLibrary Quantification Kit (ROX)适用于高通量文库定量的自动化工作站。
质量控制:
所有试剂盒组分都经过了严格的质量控制,没有可检测到的污染性外切酶和内切酶活性,并且符合严格的DNA污染要求。
重要参数:
StarLighter Library Quantification Kit(ROX)能够对准备用于lon Torrent测序的文库进行准确且可重复的基于qPCR的定量。在NGS工作流程中成功完成定量测定取决于许多因素,下面将对此进行讨论。
准确的移液操作
由于qPCR是一种非常灵敏的技术,并且该测定的动态范围可延伸至极低模板拷贝数,因此结果的可靠性高度依赖于准确的移液操作,为了保证最高的准确性,测定时必须非常小心。
以下是注意事项:
1、使用前务必确保试剂和样品完全融化并充分混合。融化和混合后,要快速离心以收集管壁上的液滴。
2、DNA的浓溶液可能很粘稠,难以准确分配小体积进行分析。
3、在样本准备的过程中,避免使用极大的稀释倍数。如果样品要非常大的稀释度才能落入测定的动态范围内,则优选进行连续稀释(例如,制备两个连续的1:100稀释液而不是单一的1:10.000稀释液)
4、如果可能,请避免使用多通道移液器。
5、每次移液要更换新的吸头,尤其在分装DNA标准品时以及制备同一样品的多个稀释度液体时。标准品和/或样品之间的交叉污染将影响定量的准确性。
6、在吸取过程中避免将吸头伸入液体太多,否则可能会导致液体粘附在吸头外部。
7、吸取任何组分后,在打出前检查吸头,以确保吸取了正确的体积。
8、务必尽可能将反应组分打到管底或管壁。
9、打出液体后上下吹吸移液器吸头2至3次。
10、打出液体后确保没有液体残留在枪头尖端。
样品浓度和稀释度
必须将文库和空白对照稀释到可测定的动态范围内。在标准品线性范围之外的任何文库稀释物都不应用于文库浓度计算。可同时对文库进行不同倍数稀释,选择落入测定动态范围内的稀释倍数对应的浓度对该文库进行定量。
文库的稀释应基于以前对相同类型文库的经验估计,或用其他方法获得的浓度信息(例如使用 NanoDrop,Qubit或2100生物分析仪)。
由于稀释的DNA在非缓冲环境中会降解,文库和对照用缓冲溶稀释和储存,例如10mM Tris-HCl,pH8.0-8.5(25°C)。可在稀释缓冲液中加入Tween@20(0.05%)以提高吸取准确性并减少塑料 管和移液管吸头对DNA的吸附。切勿用水稀释文库或对照。
使用新稀释的DNA,冰上保存。如果在室温稀释样品或经过长时间储存(即使在4°℃)后再进行qPCR,则计算的文库浓度可能变化很大和/或不准确。如果必须重新分析样品,则应重新稀释样本。
污染和无模板对照
1、始终保持良好的实验室规范,避免工作区域,试剂,消耗品和设备受到文库,DNA标准品或扩增子的污染。强烈建议在每次测定中包括无模板对照(NTC),用以检测在反应设置期间是否引入了污染。
2、从低浓度到高浓度(即从DNA标准6到DNA标准1)分配DNA标准品,每次使用新的枪头。
3、可以进行NTC反应的熔解曲线分析以确认扩增是由于DNA标准品或文库DNA污染还是由于引物二聚体形成。
4、对于这个流程,引物二聚体的形成并不少见,因为所用的循环时间也比常规qPCR长得多,这进一步增加了引物二聚体形成的机会。只要NTC扩增在DNA标准品6之后至少3个循环,引物二聚体的形成就不会影响试剂盒的性能。
反应体系
尽管该操作流程规定了20uL反应体系,但如果需要,可将体积缩小至10uL。为了提高准确度,DNA标准品/文库稀释液的体积应保持在4uL,含Primer Premix(10x)的StarLighter qPCR mix 6uL。但是,每个反应使用的模板(DNA标准品或稀释文库)的量可以根据需要进行缩放,前提是保证移液的准确性。始终使用相同体积的DNA标准品和稀释的文库,确保塑料消耗品,移液器和qPCR仪器与反应体积兼容。
重复数据,数据可靠性,通量和样本成本
qPCR是一种极其敏感的定量技术,极易受不同来源模板的影响。DNA标准品,文库样本和对照推荐使用三个重复。
为了提高通量和降低成本,重复次数可以减少到两次。但是减少重复次数可能会增加需要重新检测文库的风险。
工作流程:
准确的移液操作
1.试剂准备
1.1 准备适当体积的DNA稀释缓冲液[10mM Tris-HC1,pH8.0-8.5(25°C)+0.05%Twveen@20(可选)]。该缓冲液可以在室温或4℃下储存。使用前,请将缓冲液平衡至室温。
1.2 确保StarLighter Library Ouantification Kit(ROX)的所有组分都完全融解。
1.3尽可能减少试剂的冻融次数。合理使用情况下,试剂反复冻融30次仍能保持稳定。
使用完毕试剂存于-20℃,避光保存。
2.样品准备
2.1使用DNA稀释液以1:500比例稀释文库样本,震荡混匀10秒。
2.2准备其它稀释度文库样本,建议每个文库至少再进行2倍稀释,以确保至少有一个稀释度落在标准的动态范围内。
2.3 准备内控稀释样本(如适用)。
3.反应设置和循环
3.1根据每个样本的重复次数确定总反应次数
6个DNA标准品
待分析文库的不同稀释度样本
内控品的不同稀释度样本
无模板对照(NTC)
3.2使用下面表中的建议的反应设置准备所需的混合物体积。
反应设置:20uL体系

3.3 混匀试剂并短暂离心使液滴置于管底。
3.4 将适量的混合物分装到每个PCR管或孔中。
3.5 向所有NTC管/孔中加入4 uLPCR级水。
3.6 将每种DNA标准品4uL分配到适当的管/孔中,从最低浓度(标准品6)到最高浓度(标准品1)。
3.7 分配4 uL文库和内控样本的每个稀释度样本到适当管中。
3.8 盖上试管或密封PCR板,短暂离心,然后转移到gPCR仪器上:
3.9使用下表设置进行qPCR,在仪器软件中选择Absolute Quantification选项。根据需要调整运行参数。
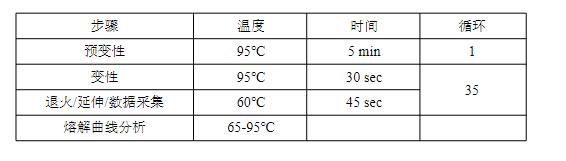
4.2检查扩增曲线的背景扣除和样本(DNA标准品,文库和对照)各重复的Cg/Ct,排除明显的异常值。样本重复间Ct值差≤0.2个。如果数据中包含许多异常值,则结果不太可靠,需要重复测定,特别要注重提高移液的准确度。4.3 排除所有超出线性范围的文库稀释倍数,即平均Cq值低于标准品1或高于标准品6的Cq/Ct值。如果文库的所有稀释度均超出标准曲线范围,根据测试结果预估稀释数重新稀释后进行测定。
4.4 使用仪器软件生成标准曲线。
4.5 检查标准曲线以确保符合以下标准:
DNA标准物之间的平均ΔCg/ΔCt值在3.0-3.6的范围内。
计算的扩增效率在90-110%的范围内(即PCR产物每个循环增加1.8-2.2倍,标准曲线的斜率 在-3.1和-3.6之间)。
R2≥0.99。
如果标准曲线不符合这些标准,则计算的文库浓度不可靠,必须重新测定。
4.6 利用qPCR软件将根据标准曲线使用绝对定量计算文库浓度和对照稀释度。
DNA标准物之间的平均ΔCg/ΔCt值在3.0-3.6的范围内。
通过将计算的平均浓度乘以以下因子计算每个文库和对照的每种稀释度的平均大小,计算校正浓度(以pM为单位):
校正浓度=[(DNA标准品大小(153 bp)/文库的平均片段长度(bp)]*平均浓度。将每个文库或对照的每种稀释度的校正浓度乘以相应释倍数以计算未稀释的文库或对照的每种稀释物的最终浓度。
最终浓度=校正浓度*稀释倍数
4.7 检查最终计算浓度并确定每个样品用于下游emPCR的工作浓度。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验分子生物学技术和应用操作之后,最常见的有:PCR;限制性酶切消化;寡核苷酸合成,以及下一代测序(NGS)的片段化、末端修饰和连接步骤。 可从凝胶中纯化 PCR 产物和 限制酶消化的 DNA 用于下游应用,例如末端修饰,连接,克隆和测序。 在寡核苷酸合成之后,聚丙烯酰胺凝胶电泳是从盐和截短序列中分离和纯化全长寡核苷酸的主要方法之一。 对于 Illumina 和 Ion Torrent NGS 平台,作为测序文库制备的一部分,样品片段化,末端修饰并连接到衔接子上。在这些步骤之后,以称为大小选择的方法