万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 提供商:
嘉兴硕玺生物有限公司
- 服务名称:
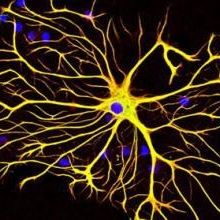
神经元细胞培养实验服务

实验技术简介:
体外神经细胞的培养已成为神经生物学研究中十分有用的技术手段。
神经细胞培养的主要优点:
(1)分散培养的神经细胞在体外生长成熟后,能保持结构和功能上的某些特点, 而且长期培养能形成髓鞘和建 立突触联系,这就提 供了体内生长过程在体外重现的机会。
(2)能在较长时间内直接观察活细胞的生长、分化、形态和功能变化,便于使用各种不同的技术方法如相差 显微镜、荧光显 微镜、电子显微镜、激光共聚焦显微镜、同位素标记、原位杂交、免疫组化和电生理等手 段进行研究。
(3)易于施行物理(如缺血、缺氧)、化学和生物因子(如 神经营养因子)等实验条件, 观察条件变更对神 经细胞的直接或间接作用。
(4)便于从细胞和分子水平探讨某些神经疾病的发病机制,药物或各种因素对胚胎或 新生动物神经细胞在 生长、发育和分化等各方面的影响。
一、液体配制:硼酸硼砂缓冲液:0.05M四硼化钠45ml,0.2M硼酸55ml,pH8.4;胰酶-EDTA消化液: 胰酶-0.125g;EDTA-0.2g;D-Hanks平衡盐液定容至100ml。所用的培养板、培养瓶或玻片预先经 100μg/L多聚赖氨酸硼酸盐缓冲液于37℃包被4h,三蒸水洗三遍晾干备用。
二、操作步骤如下:
1、出生2 d SD大鼠麻醉后,碘酒、75%乙醇消毒腹部皮肤,依次剪开皮肤、肌肉、皮下筋膜,无菌操作 下取出胚胎放入预冷的D-Hanks平衡盐液中。
2、在解剖显微镜下分离并取出胚胎大脑皮层,除去脑膜,剪碎组织成约1mm3大小,加入胰酶-EDTA消化 液并放入37℃孵箱内消化20min,中间摇晃一次。
3、随后用滴管吸出组织转移到装有预冷的培养液(DMEM+10%FBS)的离心管内终止消化液作用 5min。
4、用滴管吸出组织转移到装有预冷的DMEM+10%FBS的离心管内,用火焰抛光的巴斯德滴管吹打数 次,静置后取上清吸到另一支离心管内。重复上述步骤2~3次。
5、将所收集的上清经200目筛网过滤。
6、过滤后的细胞悬液于800r/min离心5min,弃上清,管内加入新鲜培养液(DMEM+20%FBS)并吹打 成单细胞悬液。
7、细胞计数,调整细胞密度按1.5×105/cm2种入6孔板内,放入CO2孵箱中培养。培养48h后换液并加入 Ara-C使其终浓度为1×10-5mM/L。Ara-C作用24h后全量换液。以后每隔3天半量换液一次。
三、无菌操作的注意事项: 细胞原代培养一定要保持工作区的无菌清洁,先用紫外灯杀菌1h,操作前用75%乙醇消毒,穿上实验服, 戴上口罩和帽子,操作时不能大声说话,双手戴上一次性橡胶手套,整个无菌操作都应该在酒精灯的周围 进行。
四、服务流程:
1、 讨论分析实验方案
2、 确定服务内容
3、 签订服务合同
4、 进行实验,定期向客户反馈
5、 整理实验报告
6、 完成合同内容
7、 后续实验服务,进一步合作
五、细胞服务项目: 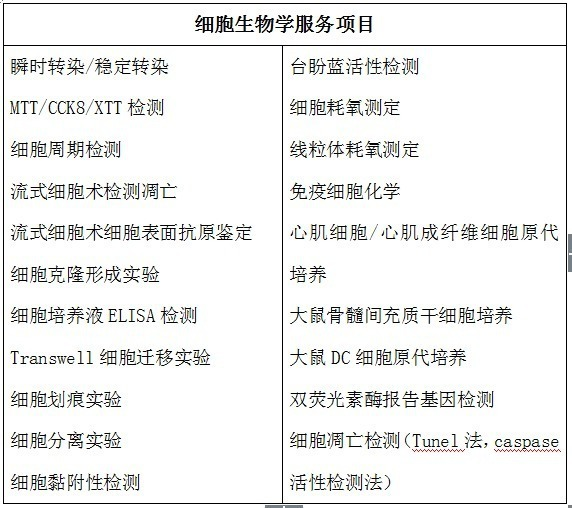
收费标准/服务周期/提供结果:
欢迎咨询详谈,我们会根据您的方案及需求制定详细的服务协议。
更多实验技术服务请浏览网站其他内容,或来电咨询!
做实验,找硕玺!您的科研生涯,我们一路相伴!
【平台项目开展范围】慢病毒,腺病毒,RNAi类,分子生物实验,病理实验,免疫学实验,细胞实验,动物实验,蛋白组学实验,芯片类实验,并为广大客户朋友们提供课题设计指导、基金申请指导等服务。
【硕玺生物】已开展了数千个实验外包项目。我们专注于医学课题研究,已从课题申请、方案设计、试剂采购、模型构造、 标本检测、数据分析,各个环节积累了数千个成功案例经验,为数千个来自临床的科研工作者解决了大量的科研问题。更多相关实验服务信息请咨询硕玺生物。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验0:05 海兔感觉-运动神经元细胞培养5 0:21 内容订阅21 0:37 内容简介37 1:22 实验预备82 3:42 准备血淋巴222 5:33 分割海兔神经节333 10:05 迁移并培养胸膜神经节605 12:25 分离运动神经元并将其与感觉神经元进行共培养745 16:53 结论1013 海兔感觉-运动神经元细胞培养本视频来源于网络,如有异议请联系我们,我们将在5个工作日内作出处理。
- University Marburg,药理学与临床药学研究所。 原文(pdf)下载: 点击下载 前言 在很多神经退化性疾病中发现了神经元凋亡与坏死。近几年来,神经科学研究中建立了几种细胞培养模式,用于体外细胞死亡机制的研究。尽管近年来科学界对神经元细胞死亡信号传导原理已经得了一定成果,但技术上的局限性依然存在,从而限制了对数据的采集与解读。而无法进行神经细胞死亡的实时监测是一个主要的技术瓶颈。目前为止,主要的细胞增殖、细胞生存与细胞死亡检测方法均为侵入式终点检测,通常对细胞有毒
称为原代细胞培养,适合用腺病毒感染。由于细胞增长缓慢,病毒感染效率较低,因此需要进行 MOI 梯度摸索实验,选择适合的 MOI 进行实验,从而提高病毒感染效率(MOI 摸索实验参考第一部分第四小节)。 原代细胞培养和感染注意事项: 1、由于原代细胞增长缓慢,使用腺病毒感染,可以在接种时提高汇合度到 50-60% 左右,确保在感染后 2 天时细胞汇合度达到 90~100%。感染非分裂细胞如神经元细胞,接种后不再增殖,可按照 100% 的汇合度进行接种。 2、若使用慢病毒感染原代细胞,建议接种时细胞