万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 提供商:
北京安必奇生物
- 服务名称:
质粒GMP生产
质粒是一类小的、双链环状DNA分子,因为具有自我复制功能,可携带染色体以外的遗传信息,被广泛应用于生物制药领域。在细胞和基因治疗产品中,质粒是转入目的基因和构建病毒载体的重要传递工具。
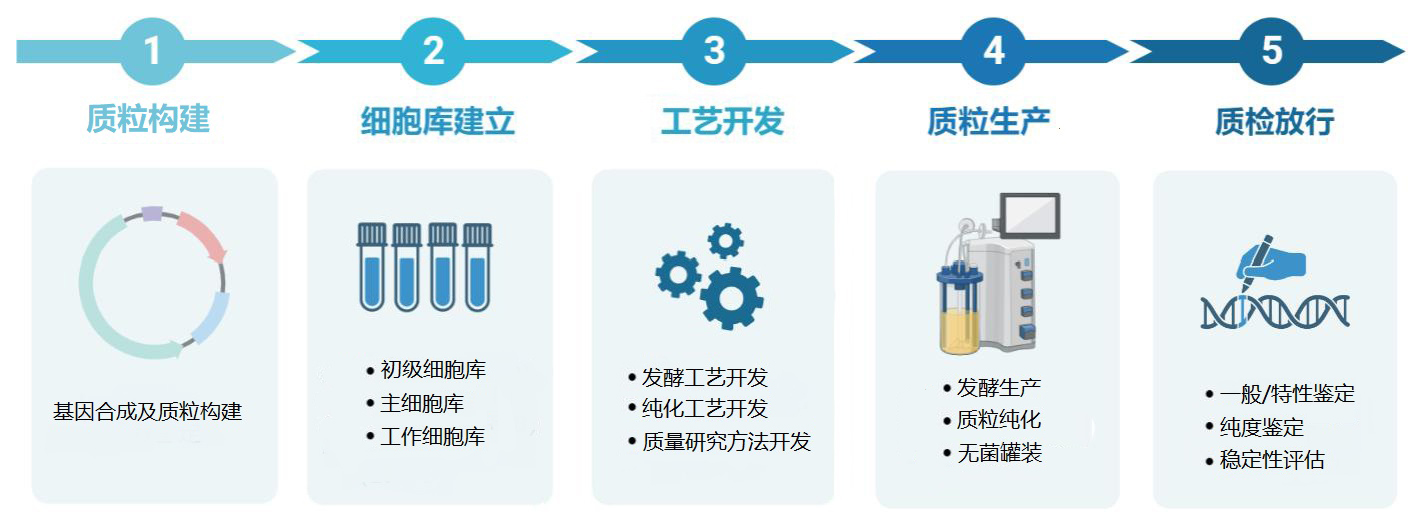
安必奇在大规模生产质粒DNA方面技术熟练、经验丰富,可以提供三种不同级别的生产服务:科研级别质粒制备、GMP-Like质粒制备和GMP工业级质粒制备。我们致力于为医药公司、工业客户提供从质粒菌种构建、克隆筛选、菌种建库、工艺开发、非临床研究级别质粒生产到临床应用GMP级别质粒生产的一站式个性化服务。
服务范围
-
研究级别质粒:适用于基础研究及药物发现研究阶段
-
GMP-Like质粒:适用于临床前研究阶段
-
GMP质粒:工业化生产阶段
服务流程
服务特色
-
稳定:可稳定性放大,并确保规模放大后质粒的纯度、活性以及收率;
-
高产:容量和技术优化的灵活性,具有跨越克至公斤的生产能力;
-
高质:发酵过程无抗生素、无动物源成分,内毒素≤0.01EU/μg,超螺旋程度90%;
主要仪器设备展示
-
拥有独立的GMP质粒生产车间
-
拥有完善的质量控制体系,完全符合法规要求
-
拥有多种发酵体系,发酵规模可达200L
交付内容
| 交付物 | 质量控制分析具体内容 | 周期 |
| 科研级别质粒 | 外观 浓度 pH值 超螺旋占比 酶切鉴定 插入序列全长测序 残留RNA 残留E.coli DNA TSE/BSE证书 |
1-2周 |
| GMP-Like级别质粒 | 外观 浓度 pH值 超螺旋占比 酶切鉴定 插入序列全长测序 残留RNA 残留E.coli DNA 内毒素含量 生物负载 TSE/BSE证书 |
1-2周 |
| GMP级别 | 外观 浓度 pH值 超螺旋占比 酶切鉴定 插入序列全长测序 残留RNA 残留E.coli DNA 残留宿主蛋白检测 内毒素含量 生物负载 支原体检测 卡纳霉素检测 TSE/BSE证书 |
2-3周 |
点击官网,在线预订:https://www.abace-biology.com/gmp-plasmid-manufacturing.htm
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验随着核酸疫苗和基因治疗的迅速发展,高纯度的,符合药物动力学的质粒DNA的需求越来越大,本人准备的论文综述初稿,对目前大规模进行质粒DNA生产的流程有一些初步见解,与大家一起探讨。 ====================================================== 综述: 质粒DNA生产工艺的研究进展 一、质粒DNA 细菌质粒(plasmid)是存在于细胞质中的一类独立于染色体的自主复制的 遗传成分,除了酵母的杀伤质粒(killer plasmid
目前,国内正规的制药行业均依据《药品生产质量管理规范》(GMP)进行工厂管理,生产环境的要求及其严格。为了保证药品质量安全,GMP中对不同类型药品的生产环境洁净度都进行了限定,因此,生产环境监测就成为了把关药品生产安全的重要一环。最新版《药品生产质量管理规范》附录1:无菌药品中,第十一条指出:“应当对微生物进行动态监测,评估无菌生产的微生物状况。监测方法有沉降菌法、定量空气浮游菌采样法和表面取样法(如棉签擦拭法和接触碟法)等。”沉降皿法是最常用的“空气微生物取样”方法,目前国标及药典中均采用
、流通领域中层层加码药品价格虚高、医院以药养医模式难以消除的现状在这十年内有了很大改观,但唯独在新药审批上市这方面的争议从来都没有停止过,每一个涉及 「药物」 的热点出现中国的新药审批制度都会被拿出来探讨一番。中国对药品监督和审核推行的是 GMP。GMP 是国际上对《药品生产质量管理规范》Good Manufacturing Practice 的简称,GMP 是世界各国对药品生产全过程监督管理时普遍采用的法定技术规范,是保证药品质量的可靠措施。中国修订发布的《中华人民共和国药品管理法》规定,药品生产
 技术资料
技术资料暂无技术资料 索取技术资料