多重免疫荧光组化技术服务
- ¥1000
- 原理介绍: 酪酰胺信号放大(TSA,Tyramide signal amplification)技术是一类利用辣根过氧化酶(HRP)对靶蛋白进行标记的酶学检测方法,类似常规免疫组化的DAB显色方法 ,TSA技术同样采用HRP标记的二抗,同样有对应的“显色”步骤(HRP催化加入反应体系的酪胺荧光素底物,产生活化荧光底物,活化底物可与抗原上的酪氨酸等残基共价结合,使样品上稳定的共价结合酪胺荧光素。之后用热修复法洗去非共价结合的一抗-二抗-HRP复合物,重复下一种一抗-hrp二抗来第二轮孵育,换另一种酪胺荧光素底物,如此往复就可实现多重标记。
- 上海
- 2025年07月15日
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 提供商:
上海古朵生物
- 服务名称:
多重免疫荧光组化技术服务
- 规格:
张
多重荧光免疫组化--TSA 技术
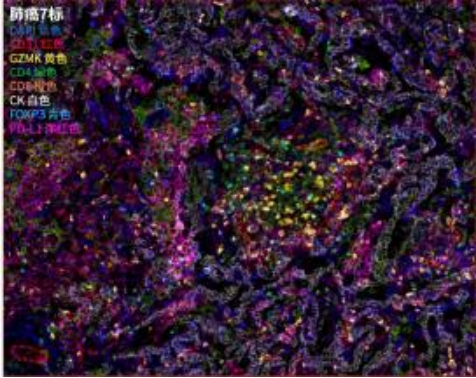
基于酪胺信号放大(TSA)技术 ,多重荧光免疫组化( mIHC)利用抗原抗体反应对样 本中多种蛋白标志物进行染色标记 ,实现在同一组织切片上多个靶标蛋白共同染色(最 多可实现数十种蛋白的共染色),从而通过荧光图像分析挖掘组织微环境中的复杂信息 , 如定量分析、共表达确定细胞分型、空间关系分析等等。
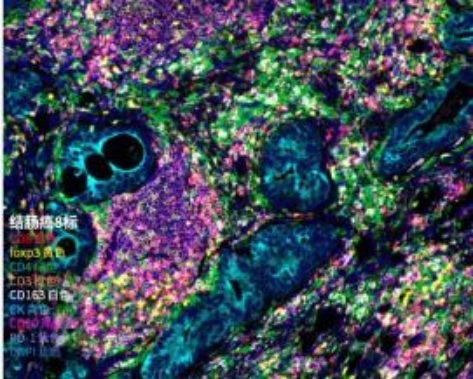
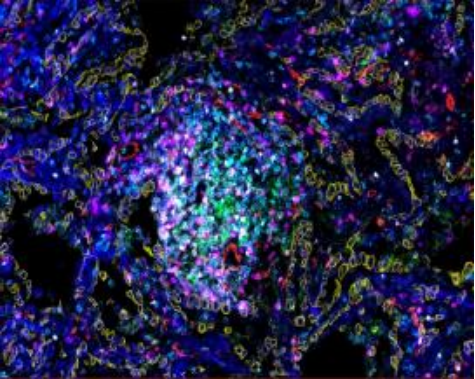
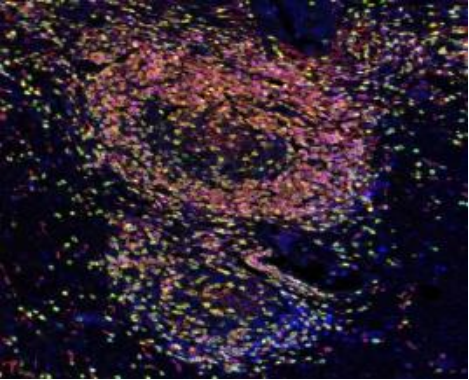
一、技术原理
酪酰胺信号放大(TSA ,Tyramide signal amplification)技术是一类利用辣根过氧化酶 ( HRP)对靶蛋白或核酸进行高密度原位标记的酶学检测方法。荧光标记的酪胺分子在 H2O2 环境下被二抗标记的 HRP 催化激活 ,产生大量的酶促反应 ,使荧光素在抗原- 抗体结合部位与组织周围的蛋白残基结合 ,形成大量的荧光素沉积 ,实现信号放大。
TSA 技术原理是荧光染料与抗原直接结合 ,通过热处理或微波处理可洗脱一抗和二抗并 同时保留与组织抗原共价结合的荧光素。因此可以通过使用不同的偶联染料多次循环实 验对多种蛋白抗原进行荧光标记 ,实现一张组织切片上多个蛋白的共染色。
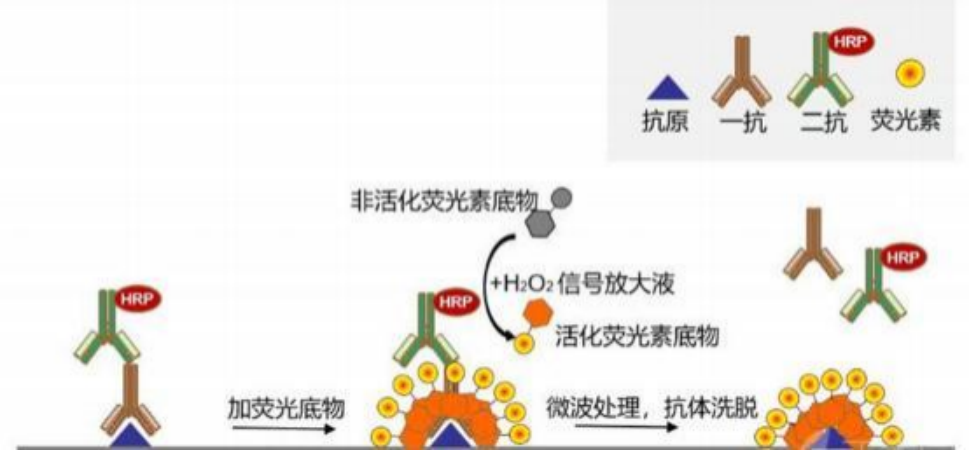
二、优势
①TSA 技术可使荧光放大信号大幅增强 ,大约是普通荧光的 3~10 倍。
②一抗抗体的种属来源不限。
普通荧光免疫组化共染的不同靶标要求一抗抗体是不同的种属来源 ,而 TSA 技术每一 轮染色后可以把上一轮的一抗和二抗洗掉 ,对后一轮染色无影响 ,因此同一种属来源的 一抗并不影响实验结果。
③实验过程中无需严格避光 ,因荧光素稳定不容易淬灭 ,实验操作过程中即使没有避光 也不影响实验结果 ,且染色后的玻片可以保存数月不淬灭 ,仍可以重新扫描。
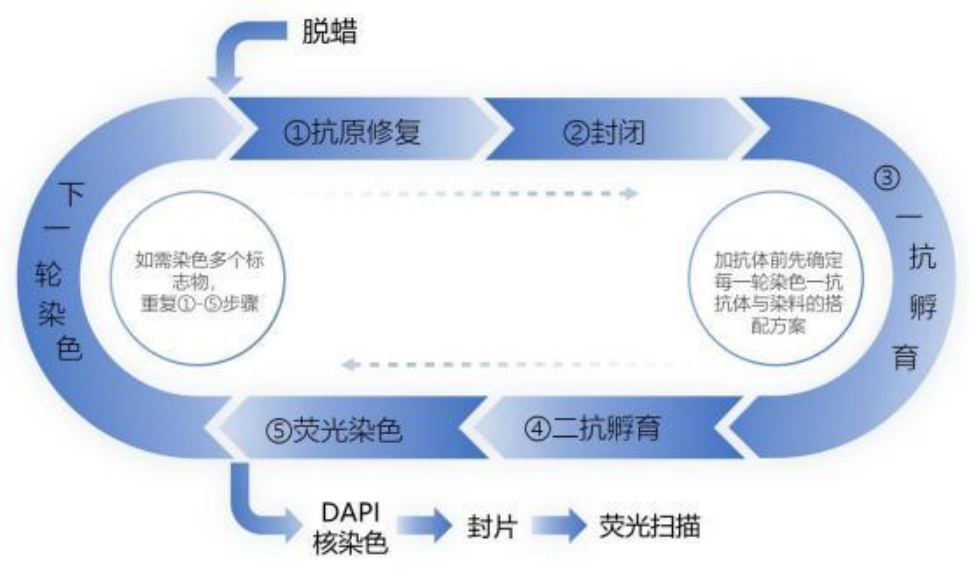
三、实验步骤
1.脱蜡和水化
将切片组织依次放入烘箱内烤片 1h →二甲苯 Ⅰ15min → 二甲苯Ⅱ15min →无水乙醇 Ⅰ5min→无水乙醇Ⅱ
2.抗原修复
根据一抗选择合适的修复液(酸性的柠檬酸钠缓冲液或碱性的 Tris-EDTA 缓冲液),将 切片组织浸没于修复液中加热至沸腾 ,中低火维持 20 min, 自然冷却至室温。
用 PBS 洗涤三次 ,每次 4 min。切片组织放入 3%过氧化氢水溶液中 ,孵育 15 min。 用 PBS 洗涤三次 ,每次 4 min。
4.封闭
在组织周围画阻水圈(防止抗体流走),在圈内加入血清封闭 10min。
5.一抗孵育
轻轻甩去封闭液 ,在圈内滴加一抗工作液覆盖组织 ,于湿盒内 4℃孵育过夜或者 37℃ 1~2h。
6.二抗孵育
用 PBS 洗涤三次 ,每次 4 min。圈内加入配置好的 HRP 标记二抗(与一抗相应种属), 避光室温孵育 30min。
7. TSA 荧光染料反应
用 PBS 洗涤三次 ,每次 4 min。圈内滴加 TSA 工作液孵育 10min。PBS 洗涤三次,每 次 4 min。
8、重复 2-7 步骤(选择对应的 TSA 荧光染料)
9、DAPI 细胞核染色
PBS 洗涤三次 ,每次 4 min。圈内滴加 DAPI 抗淬灭染液孵育 10min。
10、 封片
PBS 洗涤三次 ,每次 4 min。切片稍甩干后用抗荧光淬灭封片剂封片。
11、使用荧光扫描仪对玻片组织进行全景扫描 ,扫描图片可永久保存。
四、注意事项
①染料充分溶解混匀 ,有的试剂盒是有机溶性 ,如有沉淀 ,一定要先过滤。
②实验过程中避免切片干燥 ,并注意避免强光照射。
③选择特异性高的一抗抗体 ,优先单克隆。
④表达高的一抗搭配弱光 ,表达低的搭配强光。
⑤实验前做好方案设计 ,确定好染色顺序、修复条件 ,以及每个抗体搭配的荧光染料。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验文 章 引 用 试 剂 盒 / 方 法 :
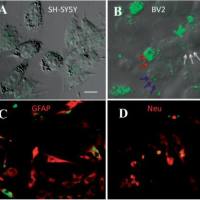
Co-staining of A, B and C was performed using a Four-color Fluorescence kit Guduo Biological Technology, shanghai, China) based on the tyramide signal amplification (TSA) technology according to the manufacture’s instruction.
Western Blot 实验 通过SDS-PAGE胶将不同的分子量的蛋白分离开,将目标蛋白转移到PVDF膜上,再利用抗原抗体的特异性结合,用特异性的一抗结合目标蛋白,用HRP标记的二抗结合一抗,再加以ECL发光液显色,检测目的蛋白在不同处理的样本中表达量的高低变化 服务优势及实验服务流程: 1、利用高性能试剂配合高通量全自动western blot机,提供超高灵敏性的western blot实验服务。超高灵敏度最低至15飞克抗原。 2、一抗的寄送需要泡沫盒加冰袋低温即送
实验流程:多靶点免疫荧光染色的实验操作与普通单标记免疫组化流程相似。试剂盒中的荧光染料可以在HRP酶的作用下将信号共价结合到抗原上,随后即可衔接下一轮单标染色,直至全部标记完成,即可复染DAPI后封片观察。1.脱蜡水合:1)新鲜二甲苯浸片10min,重复3次。2)梯度乙醇浸片,100% 5min;95% 5min;70% 2min。3)灭菌水洗片1min,重复3次。4)10%中性福尔马林浸片10min,灭菌水洗片1min,重复3次。2.微波修复:1)将脱蜡水合后的玻片置于修复杯中,用抗原
越来越多的证据表明多重荧光免疫组化 (multiplex immunohistochemistry, mIHC),又称多重免疫荧光 (multiplex immunofluorescence, mIF) 技术的稳健性和预测价值。利用多重荧光免疫组化(mIHC)/ 多重免疫荧光(mIF)进行多重成像的空间生物标志物分析有望在发现研究和临床阶段的研究中得到广泛采用。 越来越多的实验室报道正在使用 Opal 多重荧光免疫组化优化为可重复的工作流程,为该技术的稳健性和预测价值提供了很多证据
 技术资料
技术资料暂无技术资料 索取技术资料