深圳泽医原代细胞生物技术有限公司
2 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
2026年5月1日施行!《生物医学新技术管理条例》推动细胞治疗行业进入监管明确、准入清晰的新时代!
528 人阅读发布时间:2025-10-11 15:28

近日,国务院正式公布《生物医学新技术临床研究和临床转化应用管理条例》(国令第818号),将于2026年5月1日起施行!这一条例为包括细胞治疗在内的生物医学新技术发展提供了明确的法律保障和政策支持,也标志着我国生物医学领域进入规范化发展的新阶段。
立法突破:为细胞治疗提供明确法律依据
《管理条例》首次明确了生物医学新技术的法律定义,“以对健康状态作出判断或者预防治疗疾病、促进健康为目的,运用生物学原理,作用于人体细胞、分子水平,在我国境内尚未应用于临床的医学专业手段和措施”这一标准作为鉴定。

这一界定简直为细胞治疗发展行业量身定做,精准覆盖了细胞治疗技术的核心特征。
该条例建立了临床研究备案管理制度,规定临床研究机构在通过学术审查和伦理审查后,只需向国务院卫生健康部门备案就可以开展研究。这种管理方式大大简化了前期流程,为细胞治疗技术临床研究提供了便利。
机构准入:高标准保障高质量研究
条例对临床研究机构设置了明确准入条件,规定实施生物医学新技术临床研究的机构必须是三级甲等医疗机构,并且需要具备符合要求的临床研究学术委员会和伦理委员会。
同时,该条例还规定了项目负责人应当具备执业医师资格和高级职称,对项目负责人的职业道德、科学研究信誉和临床技术水平同时也做了要求。
受试者保护:伦理与权益保障并重
对于受试者的权益保护,该条例也给出了清晰明确的答案,明确规定临床研究机构实施生物医学新技术临床研究,应当取得受试者的书面知情同意。

对于无民事行为能力人或限制民事行为能力人,应当依法取得其监护人的书面知情同意。
特别需要注意的时,条例明确规定“临床研究发起机构、临床研究机构不得向受试者收取与生物医学新技术临床研究有关的费用”。这一明确规定减轻了受试者经济负担,降低了临床研究的参与门槛,同时规范了研究机构的行为。
政策联动:中央地方协同推进产业发展
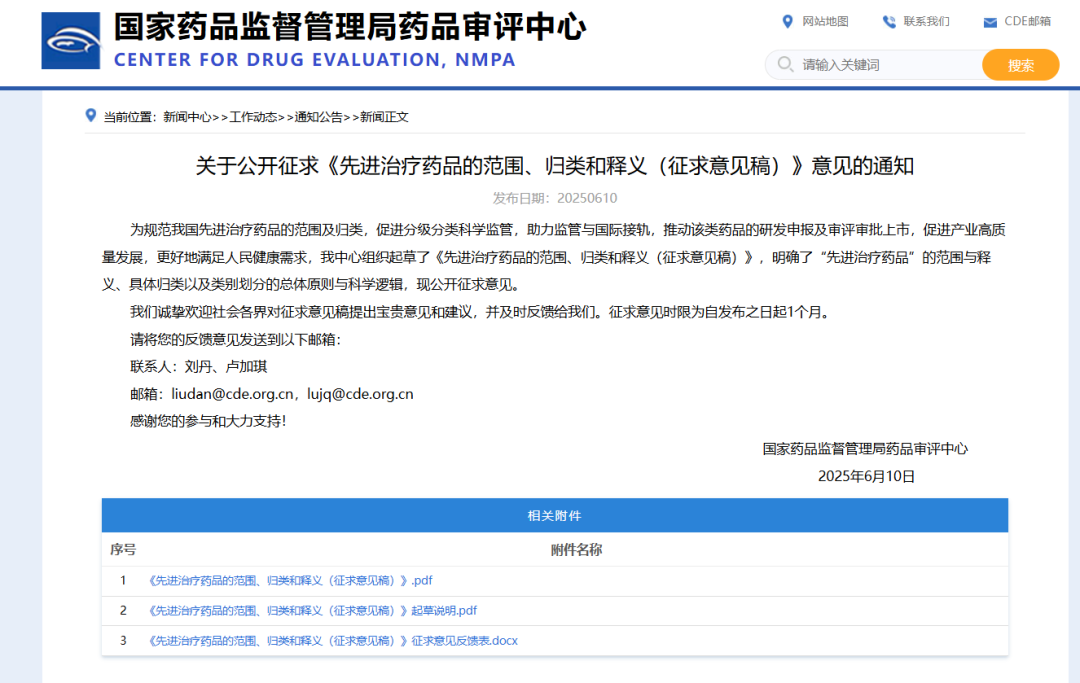
从国家到地方,一系列支持细胞治疗产业发展的政策密集出台。国家药监局药品审评中心发布《先进治疗药品的范围、归类和释义(征求意见稿)》,将细胞治疗药品与基因治疗药品等统一纳入 “先进治疗药品” 范畴。
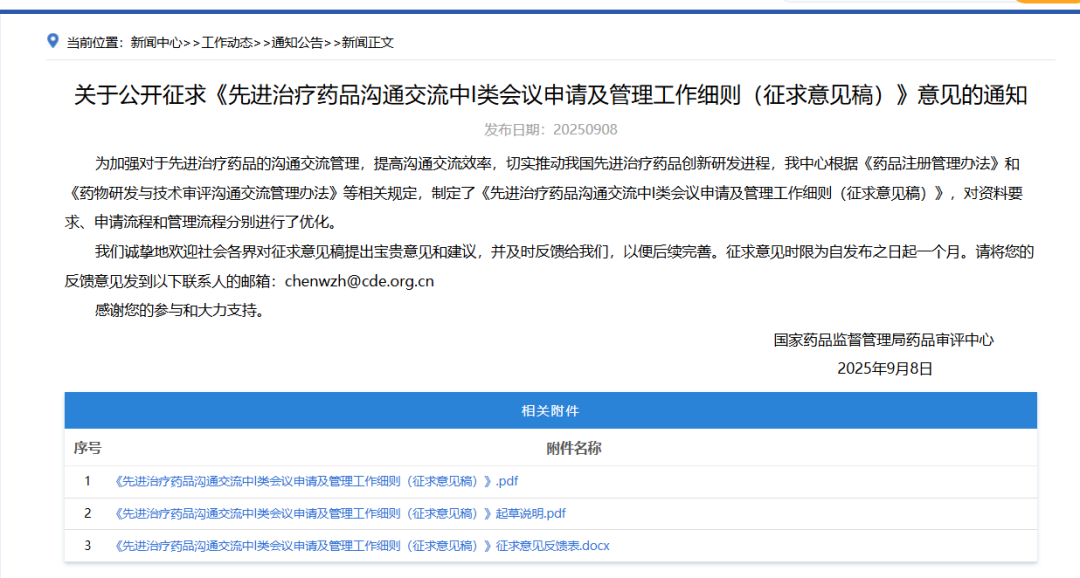
同时,《先进治疗药品沟通交流中I类会议申请及管理工作细则(征求意见稿)》拟为基因治疗、细胞治疗等前沿疗法开辟审评“高速通道”,将审评沟通周期从现行60-75天大幅压缩至30天。
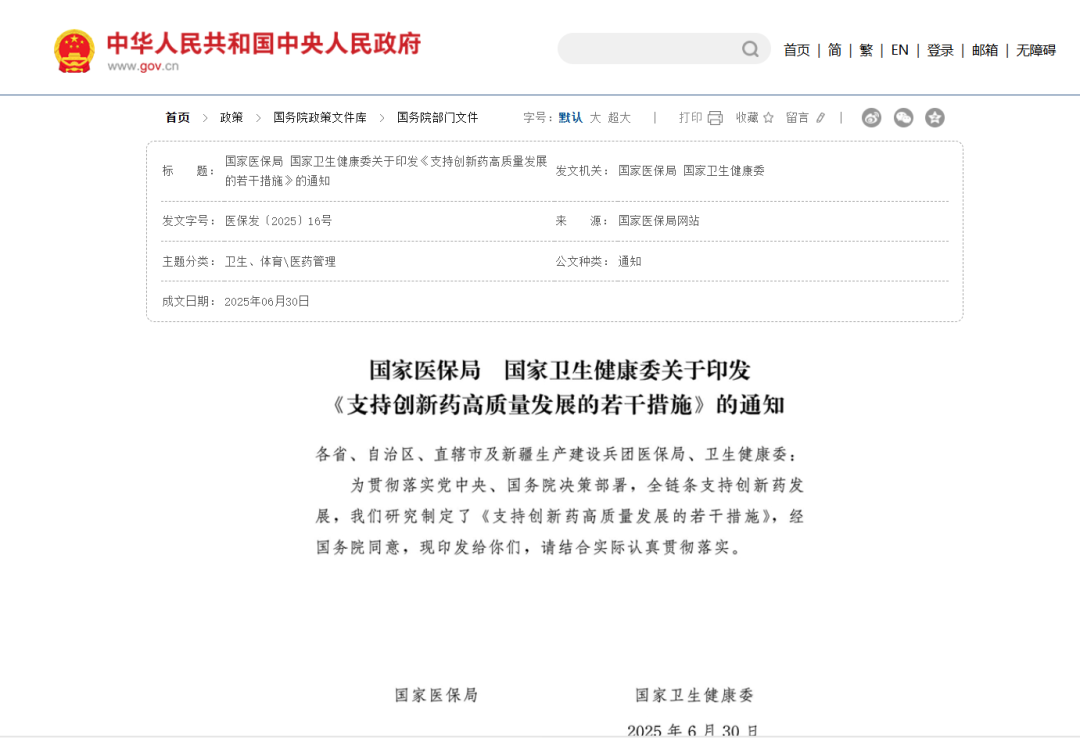
在支付端,国家医保局联合国家卫生健康委出台《支持创新药高质量发展的若干措施》,预计80%的创新药将在两年内纳入医保支付范围,为干细胞药物进入医保提供了明确的快车道。
地方层面,山东省发布了《关于支持细胞与基因治疗产业高质量发展的若干措施》,从提升创新能力、加速临床转化、培育产业生态等4方面提出18条具体措施。
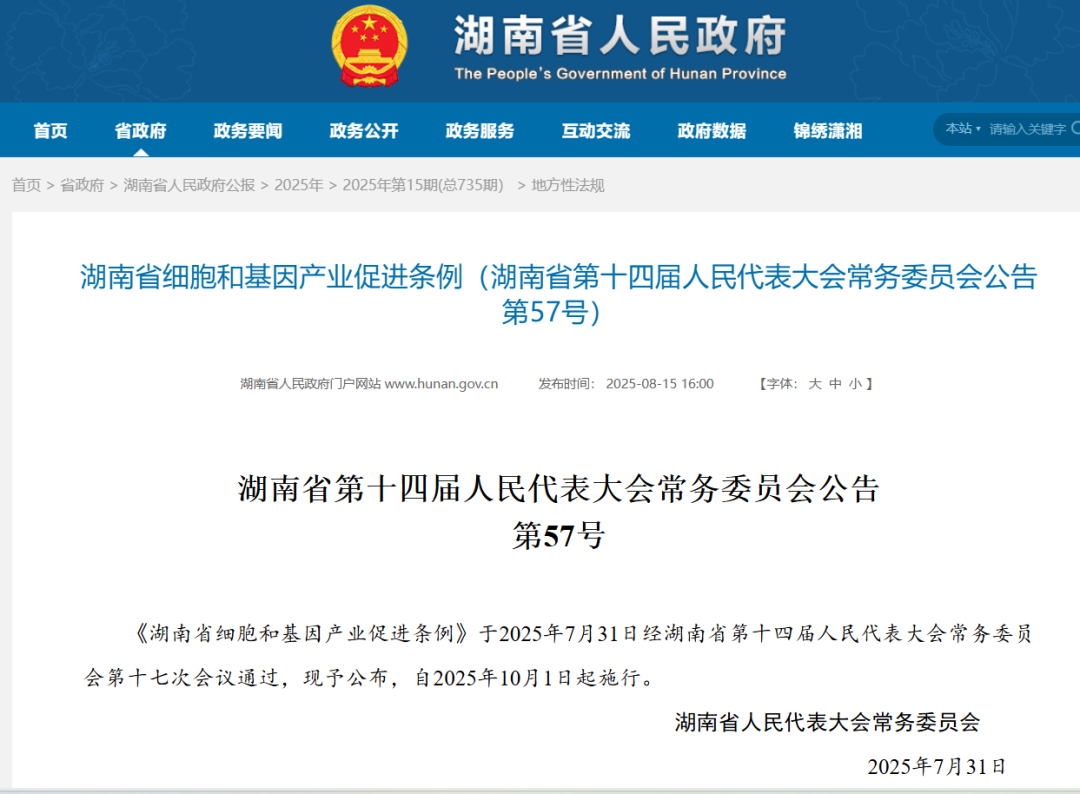
湖南省则通过了《湖南省细胞和基因产业促进条例》,成为细胞与基因领域首部省级地方性法规。
行业前景:政策驱动产业高速发展
随着政策红利持续释放,细胞治疗产业正迎来黄金发展期。从明确药品属性到医保支付配套,干细胞与基因治疗产业进入监管明确、支付明朗、准入清晰的细胞治疗发展新时代。